Hvilken ikke-kovalent binding holder aminosyrer sammen?
Du tænker dog måske på de ikke-kovalente obligationer, der stabiliserer Den tredimensionelle struktur af proteiner, der dannes af flere aminosyrer forbundet med peptidbindinger. Disse er:
* Hydrogenbindinger: Dette er svage bindinger, der dannes mellem et hydrogenatom kovalent knyttet til et stærkt elektronegativt atom (som ilt eller nitrogen) og et ensomt par elektroner på et andet elektronegativt atom. De spiller en afgørende rolle i stabiliseringen af den sekundære struktur af proteiner (alfa -helixer og betaark) og tertiær struktur.
* ioniske bindinger: Disse bindinger dannes mellem modsat ladede grupper, såsom carboxylgrupper (-coo-) og aminogrupper (-NH3+). Disse bindinger er relativt stærke og bidrager til den samlede stabilitet af proteinstruktur.
* van der Waals Forces: Disse er svage interaktioner med kort rækkevidde, der stammer fra midlertidige udsving i elektronfordeling omkring atomer. Mens de er individuelt svage, kan de kollektivt bidrage til stabiliteten af proteinstruktur, især når mange atomer er involveret.
* Hydrofobe interaktioner: Disse interaktioner er ikke teknisk bindinger, men snarere en konsekvens af tendensen til ikke -polære sidekæder af aminosyrer til at klynge sig sammen i det vandige miljø i cellen, hvilket minimerer kontakt med vandmolekyler. Denne klynge hjælper med at stabilisere proteinstrukturen.
Sidste artikelHvad sker der med atomer i brændstof?
Næste artikelHvad er metalliske malm?
 Varme artikler
Varme artikler
-
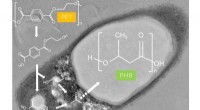 Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid.
Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid. -
 Transparente belægninger til hverdagsbrugFluoroporbelægning på en tynd kobberfilm. Kredit:Bastian E. Rapp, SÆT Vand- og smudsafvisende sportstøj og udendørstøj, eller anti-dug forruder – der er mange hverdagsprodukter, der kan drage ford
Transparente belægninger til hverdagsbrugFluoroporbelægning på en tynd kobberfilm. Kredit:Bastian E. Rapp, SÆT Vand- og smudsafvisende sportstøj og udendørstøj, eller anti-dug forruder – der er mange hverdagsprodukter, der kan drage ford -
 Biopolymerovertrukket nanokatalysator kan hjælpe med at realisere en brintbrændstofdrevet fremtidKredit:eksponeringer fra Freepik For at bekæmpe klimaændringer, skift fra fossile brændstoffer til rene og bæredygtige energikilder er bydende nødvendigt. En populær kandidat i denne henseende er
Biopolymerovertrukket nanokatalysator kan hjælpe med at realisere en brintbrændstofdrevet fremtidKredit:eksponeringer fra Freepik For at bekæmpe klimaændringer, skift fra fossile brændstoffer til rene og bæredygtige energikilder er bydende nødvendigt. En populær kandidat i denne henseende er -
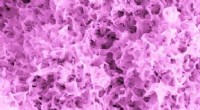 Proteiner koreograferer den uendelig lille dans af levende celler og funktionelle biomaterialerBlomsterlignende mikrostrukturer dannes på en nanoporøs glasmonolit med 31nm-diameter porer. Kredit:Lehigh University, Thamma, Kowal, Falk, Jain Et tværfagligt forskerhold ved Lehigh University ha
Proteiner koreograferer den uendelig lille dans af levende celler og funktionelle biomaterialerBlomsterlignende mikrostrukturer dannes på en nanoporøs glasmonolit med 31nm-diameter porer. Kredit:Lehigh University, Thamma, Kowal, Falk, Jain Et tværfagligt forskerhold ved Lehigh University ha


