Hvad har der store atomradii -alkalimetaller eller ædelgasser?
Forklaring:
* atomradius er afstanden fra kernen til den yderste elektronskal af et atom.
* alkalimetaller Har kun en valenselektron i deres yderste skal. Denne enkelt elektron holdes løst og oplever en svagere effektiv nuklear ladning (den nettopositive ladning, der opleves af et elektron), hvilket resulterer i en større atomradius.
* ædle gasser Har en fuld ydre skal af elektroner, der holdes tæt af kernen. Den stærke effektive atomladning tiltrækker elektronerne tættere på kernen, hvilket fører til mindre atomradier.
Eksempel:
I den tredje periode er atomradius af natrium (NA) større end argon (AR). Dette skyldes, at natrium har en valenselektron, mens Argon har en fuld ydre skal af elektroner.
Sammendrag:
Tendensen med atomradier på tværs af en periode falder fra venstre mod højre. Dette skyldes den stigende effektive atomladning, der trækker elektronerne tættere på kernen. Derfor har alkalimetaller større atomradier end ædle gasser i samme periode.
Sidste artikelHvilke kemiske reaktioner vist fra H2O O2 H2O2?
Næste artikelHvordan opløser du klippesalt?
 Varme artikler
Varme artikler
-
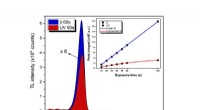 Aluminiumoxidkrystal testet som UV-strålingssensorIntensitet og temperatur. Detektering og måling af UV-eksponering i forskellige miljøer var omfanget af en undersøgelse. Kredit:Neilo Marcos Trindade og hans team Udsættelse for ultraviolet (UV) s
Aluminiumoxidkrystal testet som UV-strålingssensorIntensitet og temperatur. Detektering og måling af UV-eksponering i forskellige miljøer var omfanget af en undersøgelse. Kredit:Neilo Marcos Trindade og hans team Udsættelse for ultraviolet (UV) s -
 Forskere opretter en enhed til at identificere risici for brystkræftDemonstration af koncentrationsgradient i mikrofluidsystem ved hjælp af røde og blå farvestofopløsninger. Kredit:Purdue University Forskere ved Purdue University er ved at skabe en enhed, som de h
Forskere opretter en enhed til at identificere risici for brystkræftDemonstration af koncentrationsgradient i mikrofluidsystem ved hjælp af røde og blå farvestofopløsninger. Kredit:Purdue University Forskere ved Purdue University er ved at skabe en enhed, som de h -
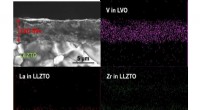 Katodefremstilling til oxid-solid-state-batterier ved stuetemperaturSEM-billede af en brudt tværsnitsoverflade af LVO-elektroden fremstillet på LLZTO-granat af AD. Tilsvarende elementær kortlægning for V, La, og Zr er også vist. Kredit:Toyohashi University of Technolo
Katodefremstilling til oxid-solid-state-batterier ved stuetemperaturSEM-billede af en brudt tværsnitsoverflade af LVO-elektroden fremstillet på LLZTO-granat af AD. Tilsvarende elementær kortlægning for V, La, og Zr er også vist. Kredit:Toyohashi University of Technolo -
 Hvor længe holder hukommelsen? Til formhukommelseslegeringer, jo længere jo bedreKredit:CC0 Public Domain Kendt for mange som muskeltråd eller memory metal, formhukommelseslegeringer er materialer, der kan bøjes eller deformeres, og derefter vende tilbage til deres oprindelige
Hvor længe holder hukommelsen? Til formhukommelseslegeringer, jo længere jo bedreKredit:CC0 Public Domain Kendt for mange som muskeltråd eller memory metal, formhukommelseslegeringer er materialer, der kan bøjes eller deformeres, og derefter vende tilbage til deres oprindelige
- Japans kapsel med asteroideprøver hentet i Australien
- Huawei sagsøger Verizon for påstået patentkrænkelse
- Biden underskriver $280B. CHIPS i et forsøg på at styrke USA over Kina
- Hvilket udtryk kan bruges til at beskrive naturlig selektion?
- Når gode brusere bliver dårlige - Leoniderne fra 2016
- Hvor mange zebrafisk udgør en skole? "Tre," siger fysikere


