Hvorfor udtrykker kemikere ofte surhedsgraden af en opløsning som pH -værdi snarere end hydrogenion koncentreret?
1. Lettere at håndtere og forstå: PH -værdier er typisk mellem 0 og 14, hvilket gør dem lettere at forstå og huske sammenlignet med hydrogenionkoncentrationer, som ofte er meget små tal (f.eks. 10⁻⁵ m).
2. Logaritmisk skala giver et bredere interval: PH -skalaen er logaritmisk, hvilket betyder, at en ændring af en PH -enhed repræsenterer en ti gange ændring i hydrogenionkoncentration. Dette gør det muligt at repræsentere en bredere vifte af surhedsgrad sammenlignet med en lineær skala af hydrogenionkoncentration, som ville kræve meget større antal.
3. Bekvemmelighed og standardisering: Brug af en standardiseret PH -skala muliggør let sammenligning af surhedsgraden af forskellige opløsninger, uanset den specifikke hydrogenionkoncentration. Dette er afgørende for kommunikation og forståelse blandt forskere.
4. Praktiske overvejelser: PH -målere er let tilgængelige og kan let måle pH -værdier direkte, hvilket gør det praktisk til eksperimentelt arbejde.
5. Menneskelig opfattelse: Den menneskelige tunge er følsom over for ændringer i surhedsgrad, men den er ikke lineær. PH -skalaen stemmer overens med den menneskelige oplevelse af surhed, hvilket gør det mere intuitivt for forståelse.
Kortfattet:
PH -skalaen tilbyder en mere praktisk, forståelig og praktisk måde at udtrykke surhedsgraden af en opløsning sammenlignet med hydrogenionkoncentration. Det giver mulighed for lettere sammenligning, kommunikation og måling, hvilket gør det til den foretrukne metode for kemikere.
Sidste artikelHvordan adskiller kogning sig fra fordampning?
Næste artikelHvorfor er radium vanskeligt at udtrække fra pitchblende?
 Varme artikler
Varme artikler
-
 Nyt elektrisk aktiveret materiale kan forbedre braillelæsereKredit:CC0 Public Domain Opdaterbare brailleskærme oversætter information fra computerskærme til hævede tegn, ofte langs bunden af et tastatur. Men denne teknologi kan koste tusindvis af dollars
Nyt elektrisk aktiveret materiale kan forbedre braillelæsereKredit:CC0 Public Domain Opdaterbare brailleskærme oversætter information fra computerskærme til hævede tegn, ofte langs bunden af et tastatur. Men denne teknologi kan koste tusindvis af dollars -
 Kortlægning af ændringer i vandmolekylers dynamik og struktur i nærheden af opløste stofferMartina Havenith har hurtigt implementeret den første forskningsidé, som hun ønskede at realisere med midler fra en prestigefyldt bevilling fra Det Europæiske Forskningsråd. Kredit:RUB, Marquard K
Kortlægning af ændringer i vandmolekylers dynamik og struktur i nærheden af opløste stofferMartina Havenith har hurtigt implementeret den første forskningsidé, som hun ønskede at realisere med midler fra en prestigefyldt bevilling fra Det Europæiske Forskningsråd. Kredit:RUB, Marquard K -
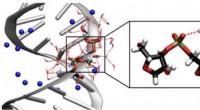 Fleksibilitet og arrangement - samspillet mellem ribonukleinsyre og vandTil venstre er en struktur af en RNA dobbelt helix. De blå kugler repræsenterer natriummodioner. Til højre er et forstørret segment af sukker-phosphat-rygraden af RNA, herunder brodannende vandmolek
Fleksibilitet og arrangement - samspillet mellem ribonukleinsyre og vandTil venstre er en struktur af en RNA dobbelt helix. De blå kugler repræsenterer natriummodioner. Til højre er et forstørret segment af sukker-phosphat-rygraden af RNA, herunder brodannende vandmolek -
 Nyt twist på CRISPR-teknologiUniversity of Delaware doktorand Emily Berckman (til venstre) og prof. Wilfred Chen har fundet en ny måde at bruge CRISPR -teknologi, der vil hjælpe kemikere, biokemikere og ingeniører, der arbejder m
Nyt twist på CRISPR-teknologiUniversity of Delaware doktorand Emily Berckman (til venstre) og prof. Wilfred Chen har fundet en ny måde at bruge CRISPR -teknologi, der vil hjælpe kemikere, biokemikere og ingeniører, der arbejder m
- Hvordan illustrerer du kemisk ændring versus fysisk i et Venn -diagram?
- Ploonets:Forviste måner kan forklare astronomiske mysterier
- En kovalent forbindelse dannes sandsynligvis fra?
- Fejl i termoelementfejl
- Generelle egenskaber ved Protista
- Hvad er en region, hvor en litosfærisk plade tvinges under en anden?


