Er alkalimetaller soldater med lav densitet ved stuetemperatur?
* atomstruktur: Alkalimetaller har en enkelt valenselektron i deres yderste skal. Dette gør dem meget reaktive og bidrager også til deres lave densitet.
* Metallisk binding: Alkalimetaller danner metalliske bindinger, hvor valenselektronerne delokaliseres og deles på tværs af hele strukturen. Dette resulterer i et løst pakket arrangement af atomer, der bidrager til lav densitet.
* Stor atomradier: Alkalimetaller har store atomradier på grund af deres enkelt valenselektron. Denne større størrelse bidrager også til den lavere densitet.
Eksempler:
* lithium (Li): 0,534 g/cm³
* natrium (NA): 0,971 g/cm³
* kalium (k): 0,862 g/cm³
* rubidium (RB): 1,532 g/cm³
* cesium (CS): 1,873 g/cm³
Som du kan se, er deres densiteter markant lavere end de fleste andre metaller.
 Varme artikler
Varme artikler
-
 Potentialet for ikke-giftige materialer til at erstatte bly i perovskit-solcellerDet er stadig en udfordring at udskifte bly med mindre giftige materialer i perovskit -solceller uden at gå på kompromis med ydeevnen. Kredit:Tsinghua University og LeadVanced PV Co., Ltd At udvik
Potentialet for ikke-giftige materialer til at erstatte bly i perovskit-solcellerDet er stadig en udfordring at udskifte bly med mindre giftige materialer i perovskit -solceller uden at gå på kompromis med ydeevnen. Kredit:Tsinghua University og LeadVanced PV Co., Ltd At udvik -
 Ioner i smeltede salte kan gå imod strømmenKredit:CC0 Public Domain I en ny artikel offentliggjort i det videnskabelige tidsskrift Kommunikationskemi , en forskergruppe ved Uppsala Universitet viser, ved hjælp af computersimuleringer, at
Ioner i smeltede salte kan gå imod strømmenKredit:CC0 Public Domain I en ny artikel offentliggjort i det videnskabelige tidsskrift Kommunikationskemi , en forskergruppe ved Uppsala Universitet viser, ved hjælp af computersimuleringer, at -
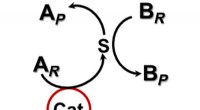 Accelererer kemiske reaktioner uden direkte kontakt med en katalysatorEt berøringsfrit katalytisk system. Kredit: Videnskabens fremskridt (2020). DOI:10.1126/sciadv.aax6637 Et forskerhold fra Northwestern University har afsløret en ny tilgang til at udføre kemiske
Accelererer kemiske reaktioner uden direkte kontakt med en katalysatorEt berøringsfrit katalytisk system. Kredit: Videnskabens fremskridt (2020). DOI:10.1126/sciadv.aax6637 Et forskerhold fra Northwestern University har afsløret en ny tilgang til at udføre kemiske -
 Brug af en nikkelkatalysator med kulbrinter til at lave fedtsyrerKunstnerens idé om nikkel, der omdanner kulbrinter til fedtsyrer. Kølere temperaturer gør, at nikkel indsætter CO2 tættere på enden af kæden. Kredit:© Ramón Andrade. 3DCiencia.com (Phys.org) – E
Brug af en nikkelkatalysator med kulbrinter til at lave fedtsyrerKunstnerens idé om nikkel, der omdanner kulbrinter til fedtsyrer. Kølere temperaturer gør, at nikkel indsætter CO2 tættere på enden af kæden. Kredit:© Ramón Andrade. 3DCiencia.com (Phys.org) – E
- Nyt modificeret CRISPR-protein kan passe ind i virus, der bruges til genterapi
- Hvad er målingen af 0,004 738 265 cm afrundet til tre signifikante cifre?
- Hvor meget Thrust genereres der i en raket med fast brændsel?
- To er bedre end én:Enkeltatom dimer elektrokatalysator til grøn brintproduktion
- Forskere samler interventioner, der adresserer ordgab, i specialudgaven af tidsskriftet
- En sætning med biosfære i?


