Hvorfor krom har et højt kogepunkt?
* stærk metallisk binding: Krom udviser stærk metallisk binding på grund af tilstedeværelsen af et stort antal delokaliserede elektroner i dens struktur. Disse elektroner danner et "hav" af elektroner, der holder metalatomerne sammen gennem elektrostatisk tiltrækning. Denne stærke binding kræver en betydelig mængde energi at bryde, hvilket resulterer i et højt kogepunkt.
* højt smeltepunkt: Krom har et højt smeltepunkt (1907 ° C), som er direkte relateret til dens stærke metalliske binding. Det høje smeltepunkt bidrager også til dets høje kogepunkt, da metallet skal overvinde stærke interatomiske kræfter til overgang fra fast til væske og derefter fra væske til gas.
* lille atomradius: Krom har en relativt lille atomradius, hvilket betyder, at dens atomer er tæt pakket sammen. Denne nærhed styrker den metalliske binding og bidrager til det høje kogepunkt.
* høj entalpi af fordampning: Krom har en høj entalpi af fordampning, hvilket betyder, at der kræves en stor mængde energi for at konvertere den fra en væske til en gas. Dette skyldes, at de stærke metalliske bindinger skal brydes for at overvinde de attraktive kræfter mellem atomerne.
Kortfattet: Kroms høje kogepunkt er et resultat af dets stærke metalliske binding, høje smeltepunkt, lille atomradius og høj entalpi af fordampning. Alle disse faktorer bidrager til den høje energi, der kræves for at overvinde de interatomiske kræfter og overgangskrom fra et fast stof til en væske og derefter fra en væske til en gas.
Sidste artikelHvordan vil du beskrive isotoperne af brint?
Næste artikelHvilke typer egenskaber ændrer sig under en kemisk reaktion?
 Varme artikler
Varme artikler
-
 Ny metode ser fibre i 3-D, bruger det til at estimere ledningsevneHver af de tre metoder, der blev brugt til at visualisere fibrene, havde fordele og ulemper. Strålestøbning viste løfte om at blive en kraftfuld tilgang til at vurdere orienteringen af fibrøse mater
Ny metode ser fibre i 3-D, bruger det til at estimere ledningsevneHver af de tre metoder, der blev brugt til at visualisere fibrene, havde fordele og ulemper. Strålestøbning viste løfte om at blive en kraftfuld tilgang til at vurdere orienteringen af fibrøse mater -
 Et skridt nærmere produktion af miljøvenlig brintbrændstofKredit:CC0 Public Domain Griffith University-forskere sigter mod at låse op for en katalytisk proces, der vil forbedre nedbrydningen af vand, til brint og oxygen og bringe Australien et skridt t
Et skridt nærmere produktion af miljøvenlig brintbrændstofKredit:CC0 Public Domain Griffith University-forskere sigter mod at låse op for en katalytisk proces, der vil forbedre nedbrydningen af vand, til brint og oxygen og bringe Australien et skridt t -
 C9h -peptid er begrænset til at fremkalde kræftcelle -apoptoseKredit:Asociación RUVID Forskere ved Valencias Universitat Politècnica (UPV), Valencia-CSIC Biomedicine Institute (IBV) og Bioengineering, Biomateriale og nanomedicin CIBER (CIBER BBN) har udvikle
C9h -peptid er begrænset til at fremkalde kræftcelle -apoptoseKredit:Asociación RUVID Forskere ved Valencias Universitat Politècnica (UPV), Valencia-CSIC Biomedicine Institute (IBV) og Bioengineering, Biomateriale og nanomedicin CIBER (CIBER BBN) har udvikle -
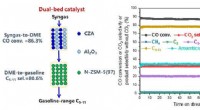 Dobbelts katalysator muliggør høj omdannelse af syngas til flydende carbonhydrider i benzininterva…Skematisk diagram for omdannelsen af syngas til flydende carbonhydrider i benzinområdet over en dobbeltbedskatalysator (CZA+Al2O3)/N-ZSM-5(97) og resultaterne af stabilitetstesten. Kredit:DICP B
Dobbelts katalysator muliggør høj omdannelse af syngas til flydende carbonhydrider i benzininterva…Skematisk diagram for omdannelsen af syngas til flydende carbonhydrider i benzinområdet over en dobbeltbedskatalysator (CZA+Al2O3)/N-ZSM-5(97) og resultaterne af stabilitetstesten. Kredit:DICP B
- Hvilket er den primordiale nebula?
- Hvordan finder jeg hastighed?
- Hvad sker der med bakterierne, når det blandes med hvide blodlegemer?
- 3D-printede hår:Professor udvikler bittesmå sensorer til at registrere flow og miljøændringer
- Hvad er den kraft, der holder ting på overfladen?
- Sort nitrogen:Forskere opdager nyt højtryksmateriale og løser et puslespil i det periodiske system


