Hvordan vil du beskrive isotoperne af brint?
1. Protium (¹H):
* mest rigelige: Udgør omkring 99,98% af alt brint.
* struktur: En proton og ingen neutroner.
* stabilitet: Stabil, ikke-radioaktiv.
2. Deuterium (²h):
* Anden mest rigelige: Udgør ca. 0,015% af alt brint.
* struktur: En proton og en neutron.
* stabilitet: Stabil, ikke-radioaktiv.
3. Tritium (³h):
* mindst rigelig: Sporbeløb, der findes i miljøet.
* struktur: En proton og to neutroner.
* stabilitet: Radioaktiv med en halveringstid på ca. 12,3 år.
Nøgleforskelle:
* Masse: Isotoper adskiller sig i deres atommasse på grund af det varierende antal neutroner.
* Radioaktivitet: Kun Tritium er radioaktivt.
* Kemiske egenskaber: Alle isotoper af brint deler de samme kemiske egenskaber på grund af at have det samme antal protoner og elektroner.
Interessante fakta:
* Deuterium bruges i nukleare fusionsreaktioner, tungt vand til atomreaktorer og som en sporstof i biologisk og kemisk forskning.
* Tritium bruges i lysende maling, selvdrevne lysenheder og som en sporstof i biologiske studier.
Kortfattet:
Hydrogenisotoper er fascinerende eksempler på, hvordan elementer kan variere i deres struktur og egenskaber, mens de stadig opretholder deres kemiske identitet. De spiller vigtige roller inden for forskellige områder, herunder nuklear videnskab, biologi og kemi.
Sidste artikelHvilke former, når noget opløses i en væske?
Næste artikelHvorfor krom har et højt kogepunkt?
 Varme artikler
Varme artikler
-
 Samarbejdsforskning kortlægger kursen til hundredvis af nye nitriderForskerne var i stand til at kortlægge, hvor nye nitrider kunne findes. Kredit:Josh Bauer/NREL Andriy Zakutayev ved, at oddsene for, at en videnskabsmand snubler over et nyt nitridmineral, er omtr
Samarbejdsforskning kortlægger kursen til hundredvis af nye nitriderForskerne var i stand til at kortlægge, hvor nye nitrider kunne findes. Kredit:Josh Bauer/NREL Andriy Zakutayev ved, at oddsene for, at en videnskabsmand snubler over et nyt nitridmineral, er omtr -
 Enheden binder metal og plastik på få sekunderSammenføjningspistolen binder metal og plastik på få sekunder og kan monteres på en robotarm i stedet for en punktsvejsepistol, for eksempel. Kredit:Fraunhofer IWS Forskere ved Fraunhofer Institut
Enheden binder metal og plastik på få sekunderSammenføjningspistolen binder metal og plastik på få sekunder og kan monteres på en robotarm i stedet for en punktsvejsepistol, for eksempel. Kredit:Fraunhofer IWS Forskere ved Fraunhofer Institut -
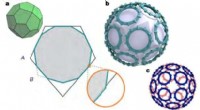 Forskere skaber umulige proteinbure i nanostørrelse ved hjælp af guldUsædvanlig geometri af TRAP-bur. Kredit: Natur (2019). DOI:10.1038/s41586-019-1185-4 Forskere fra et internationalt samarbejde er lykkedes med at skabe et proteinbur - en struktur på nanoskala, d
Forskere skaber umulige proteinbure i nanostørrelse ved hjælp af guldUsædvanlig geometri af TRAP-bur. Kredit: Natur (2019). DOI:10.1038/s41586-019-1185-4 Forskere fra et internationalt samarbejde er lykkedes med at skabe et proteinbur - en struktur på nanoskala, d -
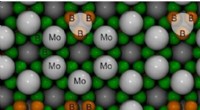 Forskere beregner krystalstruktur af superhårde molybdænboriderAtomarrangement i den højeste molybdænborid (MoB5-x) krystal Kredit:Dmitry V. Rybkovskiy, J. Phys. Chem. Lett. I deres søgen efter nye superhårde forbindelser, forskere har udført en forudsigelse
Forskere beregner krystalstruktur af superhårde molybdænboriderAtomarrangement i den højeste molybdænborid (MoB5-x) krystal Kredit:Dmitry V. Rybkovskiy, J. Phys. Chem. Lett. I deres søgen efter nye superhårde forbindelser, forskere har udført en forudsigelse
- Er H2O varmt vand og CO2 koldt vand?
- Amazon, Starbucks løfter $25, 000 hver til kampagne for folkeafstemning om Seattle hovedskat
- Nogle overraskelser om nedbrydning af mikroplast i vores oceaner
- Hvordan gør salt vand tungere?
- Sandt eller falske to celler produceret under den første cytokinesis hos kvindelige dyr er tilnærm…
- Hvad er den tvillingplanet af Jupiter?


