Hvilket stof kan bruges til at elektrolysere vand?
Her er hvorfor:
* elektrolyse involverer at bruge elektricitet til at opdele en forbindelse i dens bestanddele. I tilfælde af vand (H₂O) ønsker vi at opdele det i brintgas (H₂) og iltgas (O₂).
* Vand i sig selv er en meget dårlig leder af elektricitet. Det har brug for et stof, der kan opløses og give ioner til at bære den elektriske strøm.
* stærke elektrolytter , ligesom salte, dissocieres fuldstændigt i ioner, når de opløses i vand. Disse ioner kan derefter bære den elektriske strøm og lette elektrolyseprocessen.
Sådan fungerer det:
1.. opløsning af elektrolytten: Saltet opløses i vand, hvilket skaber en opløsning, der indeholder positivt ladede kationer (f.eks. Na⁺) og negativt ladede anioner (f.eks. Cl⁻).
2. Anvendelse af strøm: Når en elektrisk strøm ledes gennem opløsningen, migrerer de positivt ladede kationer mod den negative elektrode (katode), og de negativt ladede anioner migrerer mod den positive elektrode (anode).
3. Elektrokemiske reaktioner: Ved elektroderne forekommer kemiske reaktioner:
* katode: Vandmolekyler får elektroner og reduceres til brintgas (2H₂O + 2E⁻ → H₂ + 2OH⁻).
* anode: Vandmolekyler mister elektroner og oxideres til iltgas (2H₂O → O₂ + 4H⁺ + 4E⁻).
Vigtig note: Brug af en stærk elektrolyt er afgørende. Svage elektrolytter, der kun delvist dissocieres, ville ikke give nok ioner til at udføre elektriciteten effektivt til vandelektrolyse.
Sidste artikelEr salt en elektrolyt eller ikke -elektrolyt?
Næste artikelHvad er 5 analysemetoder i kemi?
 Varme artikler
Varme artikler
-
 En rose inspirerer til smart måde at opsamle og rense vand påKredit:Cockrell School of Engineering, University of Texas i Austin Rosen kan være et af de mest ikoniske symboler på kærlighedens skrøbelighed i populærkulturen, men nu kunne blomsten indeholde m
En rose inspirerer til smart måde at opsamle og rense vand påKredit:Cockrell School of Engineering, University of Texas i Austin Rosen kan være et af de mest ikoniske symboler på kærlighedens skrøbelighed i populærkulturen, men nu kunne blomsten indeholde m -
 Video:Hvordan kommunikerer planter med hinanden?Kredit:The American Chemical Society Forår er i luften! Det er tid til at slå græsplænen og indånde duften af nyslået græs. Men denne behagelige forårsduft kan faktisk være et kemisk råb om hjæ
Video:Hvordan kommunikerer planter med hinanden?Kredit:The American Chemical Society Forår er i luften! Det er tid til at slå græsplænen og indånde duften af nyslået græs. Men denne behagelige forårsduft kan faktisk være et kemisk råb om hjæ -
 Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit
Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit -
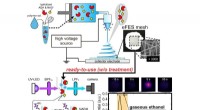 Bygning af bedre gasfasebiosensorer til bekæmpelse af sygdommeElektrospinningsenzymstrengen blev lavet med enzym- og coenzymholdig vandopløselig polymeropløsning (øverst). Det fremstillede elektrospinningsfluorometriske enzymstreng (eFES) mesh blev sat på fluore
Bygning af bedre gasfasebiosensorer til bekæmpelse af sygdommeElektrospinningsenzymstrengen blev lavet med enzym- og coenzymholdig vandopløselig polymeropløsning (øverst). Det fremstillede elektrospinningsfluorometriske enzymstreng (eFES) mesh blev sat på fluore
- Store opgaver:Sikkerhed, planlægningsnøgle til at øge produktionsydelsen hos Spallation Neutron S…
- Er alle stødende klipper dannet inde i jorden?
- Hvilke egenskaber er fælles for både syrer og baser?
- Sådan forklares tæthed over for grundlæggende studerende
- Sådan beregnes termisk udvidelse af en cylinder
- Ny forskning afslører politiske ændringer forårsaget af Den Sorte Død


