Hvis helium ikke overholder Octer -reglen, hvorfor reagerer sit atom?
* Octet -reglen: Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af otte elektroner i deres yderste skal (Valence Shell). Denne stabilitet kommer fra at have et komplet sæt elektroner i valensskallen, der efterligner elektronkonfigurationen af ædelgasser.
* Heliums elektronkonfiguration: Helium har kun to elektroner i sin yderste skal, som også er dens eneste skal. Denne konfiguration er allerede stabil, da den fylder 1s orbital fuldstændigt.
* hvorfor Helium ikke reagerer: Fordi helium har en fuld valensskal, behøver det ikke at vinde, miste eller dele elektroner for at opnå stabilitet. Dette gør det ekstremt ureaktivt, og det danner sjældent kemiske bindinger.
Undtagelser fra Octet -reglen
Mens Octet -reglen er en nyttig retningslinje, er der nogle undtagelser:
* elementer med færre end 8 valenselektroner: Elementer som brint (H) og lithium (Li) er stabile med kun to elektroner i deres valensskal.
* elementer med mere end 8 valenselektroner: Større atomer som fosfor (P) og svovl (er) kan undertiden have mere end otte elektroner i deres valensskal på grund af tilgængeligheden af tomme D -orbitaler.
Konklusion: Heliums stabilitet kommer fra dens unikke elektronkonfiguration, ikke fra at følge Octet -reglen. Dette gør det til et ekstremt ureaktivt element, der sjældent deltager i kemiske reaktioner.
Sidste artikelHvad er atommassen af thallium 203 og 205?
Næste artikelHvordan bruges isotoper i biologi?
 Varme artikler
Varme artikler
-
 En undersøgelse af Rose -vinduet ustabilitetFigur fra “Den elektriske honningkage; en undersøgelse af Rose -vinduet ustabilitet ” Royal Society Open Science for nylig udgivet The Electric Honeycomb; en undersøgelse af ustabiliteten i vind
En undersøgelse af Rose -vinduet ustabilitetFigur fra “Den elektriske honningkage; en undersøgelse af Rose -vinduet ustabilitet ” Royal Society Open Science for nylig udgivet The Electric Honeycomb; en undersøgelse af ustabiliteten i vind -
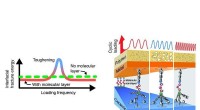 Nanoglue kan gøre kompositter flere gange hårdere under dynamisk belastningIllustrationer af frekvensafhængig hærdning i en polymer-metal-nanogl-keramisk komposit. Kredit:Rensselaer Polytekniske Institut I en opdagelse, der kunne bane vejen for nye materialer og anvendel
Nanoglue kan gøre kompositter flere gange hårdere under dynamisk belastningIllustrationer af frekvensafhængig hærdning i en polymer-metal-nanogl-keramisk komposit. Kredit:Rensselaer Polytekniske Institut I en opdagelse, der kunne bane vejen for nye materialer og anvendel -
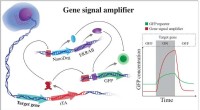 Stærke signaler viser, hvordan proteiner kommer og gårGensignalforstærkeren udviklet af bioscientists ved Rice University udmærker sig ved at detektere ekspressionen af målgener og kan også bruges til at detektere potentielt ethvert cellulært gen. Fors
Stærke signaler viser, hvordan proteiner kommer og gårGensignalforstærkeren udviklet af bioscientists ved Rice University udmærker sig ved at detektere ekspressionen af målgener og kan også bruges til at detektere potentielt ethvert cellulært gen. Fors -
 Tæller perovskitterGlasrør med kvanteprikker af perovskit -nanokrystaller, lysende med alle regnbuens farver under ultraviolet stråling. Kredit:Shutterstock Marina Filip, Postdoktoral forskningsassistent, og Felicia
Tæller perovskitterGlasrør med kvanteprikker af perovskit -nanokrystaller, lysende med alle regnbuens farver under ultraviolet stråling. Kredit:Shutterstock Marina Filip, Postdoktoral forskningsassistent, og Felicia
- Hvilken slags lys varmer stratosfæren?
- Hvor står en person, hvis de oplever total solformørkelse?
- Politivold og bystander-effekten forklaret
- 20-somethings, der administrerer millioner:Hvordan venturekapital ændrer sig
- Kortlægning af politik for, hvordan EU kan reducere dens indvirkning på tropisk skovrydning
- Undersøgelse afslører detaljer om logiske kredsløb bygget ved hjælp af levende slimforme


