Hvad gør atomerne under en reaktion, der viser, at de overholder bevarelse af masse?
* atomer oprettes ikke eller ødelægges: Det grundlæggende princip i bevarelsen af masse siger, at stof ikke kan skabes eller ødelægges i almindelige kemiske og fysiske ændringer. Dette betyder, at det samlede antal atomer i hvert element på reaktantsiden (udgangsmaterialerne) skal svare til det samlede antal atomer for hvert element på produktsiden (de dannede stoffer).
* omarrangement, ikke forsvinden: Under en kemisk reaktion går atomer ikke tabt eller opnås. I stedet omorganiserer de simpelthen sig selv for at danne nye molekyler eller forbindelser. Atomerne selv forbliver uændrede.
* afbalancering af kemiske ligninger: Vi bruger afbalancerede kemiske ligninger til at repræsentere dette princip. Koefficienterne foran hver kemisk formel indikerer antallet af molekyler eller mol af hvert involveret stof. Ved at afbalancere ligningen sikrer vi, at det samme antal atomer i hvert element er til stede på begge sider af ligningen.
Eksempel:
Overvej forbrænding af metan (CH₄):
ch₄ + 2o₂ → CO₂ + 2H₂O
* reaktanter: 1 carbon (C), 4 hydrogen (H) og 4 ilt (O) atomer.
* Produkter: 1 carbon (C), 4 hydrogen (H) og 4 ilt (O) atomer.
Atomerne omarrangeres simpelthen med carbon- og brintatomer fra methan, der kombinerer med iltatomer fra luften til dannelse af kuldioxid og vand. Det samlede antal af hver type atom forbliver det samme, hvilket demonstrerer bevarelse af masse.
Sidste artikelHvordan er metalliske malm nyttige?
Næste artikelHvilket fedtmolekyle har de fleste H -atomer?
 Varme artikler
Varme artikler
-
 Ny teknik bringer studiet af molekylær konfiguration ind i det mikroskopiske domæneRohit Bhargava med postdoktor Kevin Yeh, der designede det brugerdefinerede infrarøde mikroskop, der blev brugt til denne undersøgelse. Dette foto er taget i februar 2020. Kredit:L. Brian Stauffer, Un
Ny teknik bringer studiet af molekylær konfiguration ind i det mikroskopiske domæneRohit Bhargava med postdoktor Kevin Yeh, der designede det brugerdefinerede infrarøde mikroskop, der blev brugt til denne undersøgelse. Dette foto er taget i februar 2020. Kredit:L. Brian Stauffer, Un -
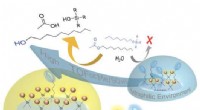 Nøglebeviser, der forbinder hydrofobicitet med effektiv syrekatalyseForenklet skematisk, der viser, hvordan alkylacetater med lange haler ikke kan nærme sig sure sulfo-steder (blå skiver) i hydrofile miljøer; imidlertid, de kan nærme sig hydrofobe miljøer med flere me
Nøglebeviser, der forbinder hydrofobicitet med effektiv syrekatalyseForenklet skematisk, der viser, hvordan alkylacetater med lange haler ikke kan nærme sig sure sulfo-steder (blå skiver) i hydrofile miljøer; imidlertid, de kan nærme sig hydrofobe miljøer med flere me -
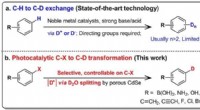 Præcis deuteration ved hjælp af tungt vandFigur viser sammenligningen mellem den konventionelle H/D-udveksling (baseret på CH-bindinger) og den nye tungvandssplittemetode (baseret på C-X-bindinger). Kredit:National University of Singapore
Præcis deuteration ved hjælp af tungt vandFigur viser sammenligningen mellem den konventionelle H/D-udveksling (baseret på CH-bindinger) og den nye tungvandssplittemetode (baseret på C-X-bindinger). Kredit:National University of Singapore -
 Ny prøveholder til proteinkrystallografiOp til tre individuelle dråber kan anbringes på prøveholderen. Kredit:HZB Proteiner er enorme molekyler, der ofte har kompleks tredimensionel struktur og morfologi, der kan omfatte sidekæder, fold
Ny prøveholder til proteinkrystallografiOp til tre individuelle dråber kan anbringes på prøveholderen. Kredit:HZB Proteiner er enorme molekyler, der ofte har kompleks tredimensionel struktur og morfologi, der kan omfatte sidekæder, fold
- Afsløring af teknologier til fremtidige løfteraketter
- Forstå hvordan bakterier opsøger og bevæger sig mod mad
- NASA finder kraftige regngivende tordenbyger i orkanen Bud
- Er natriumhypoklorit frit klor?
- Oxygen afgives, i hvilken biokemisk proces?
- Hvilken klynge af stjerner er også kendt som ploven eller vognen?


