Hvorfor bariumsulfat ikke opløses i HCL?
* lav opløselighed: Bariumsulfat er i sagens natur meget dårligt opløseligt i vand. Dette betyder, at det ikke let nedbrydes i sine bestanddele (BA 2+ og så 4 2- ) i opløsning.
* stabilt fast stof: Bariumsulfat danner en meget stabil fast gitterstruktur. De stærke elektrostatiske attraktioner mellem bariumkationerne (BA 2+ ) og sulfatanioner (så 4 2- ) gør det vanskeligt for ionerne at adskille og opløses.
* Ingen reaktion med HCL: Mens HCL er en stærk syre, reagerer den ikke med bariumsulfat for at danne en opløselig forbindelse. Chloridionerne (cl - ) fra HCL fortrænger ikke let sulfationerne (så 4 2- ) fra den faste struktur.
Vigtig note: Selvom bariumsulfat ikke opløses i HCI, kan det opløses i koncentreret svovlsyre (H 2 Så 4 ). Dette skyldes, at tilsætningen af overskydende sulfationer skifter ligevægt mod dannelsen af mere opløseligt bariumsulfat, hvilket effektivt opløses det faste. Dette er dog en højt specialiseret reaktion og ikke typisk brugt i hverdagens scenarier.
Sammenfattende gør kombinationen af lav opløselighed, stabil fast struktur og mangel på en reaktion med HCI bariumsulfat uopløselig i saltsyre.
 Varme artikler
Varme artikler
-
 Team løser et årti gammelt mysterium i kemiske transformationerPariserhjulet viser den katalytiske carboxylcyklus. Kredit:Cortland Johnson Forskere ved Pacific Northwest National Laboratory (PNNL) har løst et mysterium for en kemisk reaktion, der er afgørende
Team løser et årti gammelt mysterium i kemiske transformationerPariserhjulet viser den katalytiske carboxylcyklus. Kredit:Cortland Johnson Forskere ved Pacific Northwest National Laboratory (PNNL) har løst et mysterium for en kemisk reaktion, der er afgørende -
 Nye syntetiske polymerer kan føre til større afgrødeudbytter for landmændKredit:Unsplash/CC0 Public Domain Forskere ved University of Birmingham har opfundet en ny metode til at tilskynde bakterier til at danne vækstfremmende økosystemer, der kan bruges til at belægge r
Nye syntetiske polymerer kan føre til større afgrødeudbytter for landmændKredit:Unsplash/CC0 Public Domain Forskere ved University of Birmingham har opfundet en ny metode til at tilskynde bakterier til at danne vækstfremmende økosystemer, der kan bruges til at belægge r -
 Forskere designer opgraderingsenhed til massespektrometreSkoltech og MIPT-forsker Yury Kostyukevich, en af skaberne af den nye enhed. Kredit:Skoltech Forskere fra Skoltech og MIPT har udviklet en enhed til at opgradere massespektrometre, der bruges ti
Forskere designer opgraderingsenhed til massespektrometreSkoltech og MIPT-forsker Yury Kostyukevich, en af skaberne af den nye enhed. Kredit:Skoltech Forskere fra Skoltech og MIPT har udviklet en enhed til at opgradere massespektrometre, der bruges ti -
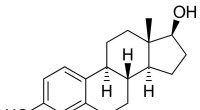 Østrogene og anti-østrogene virkninger af PFAS'er kan afhænge af tilstedeværelsen af østrogenEstradiol, det største østrogen kønshormon hos mennesker og en meget brugt medicin. Kredit:Public Domain Perfluoralkylstoffer (PFASer) har modtaget intens kontrol i de seneste år på grund af deres
Østrogene og anti-østrogene virkninger af PFAS'er kan afhænge af tilstedeværelsen af østrogenEstradiol, det største østrogen kønshormon hos mennesker og en meget brugt medicin. Kredit:Public Domain Perfluoralkylstoffer (PFASer) har modtaget intens kontrol i de seneste år på grund af deres
- Landet i Vega Granada-området aftager op til en centimeter om året som følge af tørken
- Bilomkostninger gør Singapore til verdens dyreste by. Igen.
- Hvilket lag af jorden kommer geotermisk energi fra?
- Kuldioxidemissioner fra globalt fiskeri større end hidtil antaget
- En lille smule spyt afslører meget om, hvad der bor i din mund
- RACE dashboard nu tilgængeligt


