Hvordan kan massen af et atom fra periodisk repræsenteres med hensyn til mol?
Sådan fungerer det:
* atommasse: Den periodiske tabel viser atommassen for hvert element. Denne masse udtrykkes i atommasseenheder (AMU) .
* molmasse: En mol af ethvert element indeholder Avogadros nummer (6,022 x 10^23) atomer. Den molære masse er massen af en mol af dette element. Det er numerisk lig med atommassen, men enhederne er gram pr. Mol (g/mol) .
Eksempel:
* carbon (c): Atommassen af kulstof er 12,01 amu. Dette betyder, at et carbonatom vejer 12.01 amu.
* Molær masse af kulstof: Den molære masse af kulstof er 12,01 g/mol. Dette betyder, at en mol carbonatomer vejer 12,01 gram.
forhold:
Atommassen og molmassen er direkte relateret:
* atommasse (amu) =molmasse (g/mol)
Nøglepunkt: Den periodiske tabel giver dig mulighed for hurtigt at finde den molære masse af ethvert element, som er vigtig for at udføre støkiometriske beregninger.
Sidste artikelHvis den atommasse af et kulstof er 12 amu 1 mol rent vil have af?
Næste artikelHvilke mineraler opløses i vand?
 Varme artikler
Varme artikler
-
 Spejle kontrollerer kemisk selektivitetIndsprøjtning af reaktionsblandingen i det optiske hulrum ændrer hastigheden af den kemiske reaktion. Kredit:University of Strasbourg En kemisk reaktion omdanner de molekyler, der udgør stoffet.
Spejle kontrollerer kemisk selektivitetIndsprøjtning af reaktionsblandingen i det optiske hulrum ændrer hastigheden af den kemiske reaktion. Kredit:University of Strasbourg En kemisk reaktion omdanner de molekyler, der udgør stoffet. -
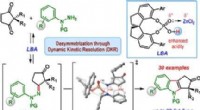 Enantioselektiv syntese af indolderivaterKredit:Wiley Indoler, og strukturer afledt af dem, er en del af mange naturlige stoffer, såsom aminosyren tryptofan. En ny katalytisk reaktion producerer cyclopenta[ b ] indoler - rammer lavet af
Enantioselektiv syntese af indolderivaterKredit:Wiley Indoler, og strukturer afledt af dem, er en del af mange naturlige stoffer, såsom aminosyren tryptofan. En ny katalytisk reaktion producerer cyclopenta[ b ] indoler - rammer lavet af -
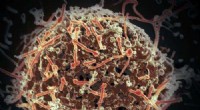 Muterende Ebolas nøgleprotein kan stoppe replikationEbola virus, isoleret i november 2014 fra patientblodprøver opnået i Mali. Virusset blev isoleret på Vero-celler i en BSL-4-suite på Rocky Mountain Laboratories. Kredit:NIAID Forskere kan muligvis
Muterende Ebolas nøgleprotein kan stoppe replikationEbola virus, isoleret i november 2014 fra patientblodprøver opnået i Mali. Virusset blev isoleret på Vero-celler i en BSL-4-suite på Rocky Mountain Laboratories. Kredit:NIAID Forskere kan muligvis -
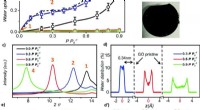 Opsuger vandet og sveden - et nyt super tørremiddelVandadsorption af grafenoxid. (a) Adsorptionsisotermer af GO, silicagel, grafit og rGO ved 25 °C. (b) Fotografi af GO-laminater (toptørret ved 80 °C og bundmættet ved P P0−1 =0,6). (c) XRD-mønstre af
Opsuger vandet og sveden - et nyt super tørremiddelVandadsorption af grafenoxid. (a) Adsorptionsisotermer af GO, silicagel, grafit og rGO ved 25 °C. (b) Fotografi af GO-laminater (toptørret ved 80 °C og bundmættet ved P P0−1 =0,6). (c) XRD-mønstre af
- Hvor meget størrelse lysstyrke har stjernerne i Cassiopeia?
- Hvilken type nuværende AC eller DC var Tesla og Edison hver promovering som det bedre valg?
- Hvad er spredt stof?
- Hvad havde nazisterne med arkæologi at gøre?
- Hvad fordøjes enzymer fedt i?
- Hvordan 'løbebåndstransportbåndet' sikrer korrekt celledeling


