Enantioselektiv syntese af indolderivater
Kredit:Wiley
Indoler, og strukturer afledt af dem, er en del af mange naturlige stoffer, såsom aminosyren tryptofan. En ny katalytisk reaktion producerer cyclopenta[ b ] indoler - rammer lavet af tre ringe, der er forbundet ved kanterne - meget selektivt og med den ønskede rumlige struktur. Som et forskerhold rapporterer i tidsskriftet Angewandte Chemie , hastighederne for de forskellige reaktionstrin spiller en afgørende rolle.
Indolderivater er vidt udbredt i naturen; de er en del af serotonin og melatonin, samt mange alkaloider - hvoraf nogle bruges som lægemidler, for eksempel, som behandling for Parkinsons sygdom. Indol er en aromatisk seksleddet ring smeltet sammen til en femleddet ring langs den ene kant. Den femleddede ring har en dobbeltbinding og et nitrogenatom. Den grundlæggende indolramme kan udstyres med en række sidegrupper eller bindes til yderligere ringe. Indol og mange indolderivater kan fremstilles ved en indolsyntesereaktion udviklet af og opkaldt efter Emil Fischer (syreassisteret kondensation af ketoner med phenylhydraziner).
Den vigtigste klasse af indolderivater er cyclopentan[b]indoler - molekyler med et skelet lavet af en indolenhed og en yderligere femleddet ring. Denne femleddede ring kan indeholde et chiralt kulstofcenter, som er et ringkulstof, der har to yderligere sidegrupper, og det kan arrangeres på to måder, der er spejlbilleder af hinanden. Kun en af de to enantiomerer, eller spejlbilleder, findes i naturen. Imidlertid, den klassiske Fischer-indolsyntese producerer en blanding af begge enantiomerer.
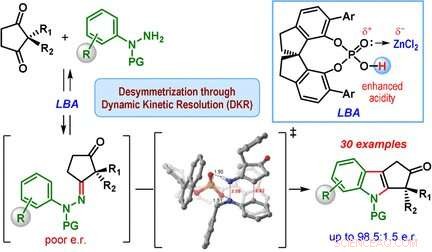
Et hold ledet af Santanu Mukherjee og Garima Jindal ved Indian Institute of Science, Bangalore (Indien) har nu udviklet en katalytisk version af Fischer-indolsyntesen, der primært producerer en af enantiomererne (dvs. reaktionen er enantioselektiv). Udgangsmaterialerne er en klasse af diketoner (2, 2-disubstitueret cyclopentan-1, 3-dioner) og phenylhydrazinderivater udstyret med særlige beskyttelsesgrupper. Hemmeligheden bag deres succes er en særlig katalysator:en chiral, cyklisk fosforsyre. Reaktionen udføres i nærværelse af zinkchlorid som en co-katalysator og en sur kationbytterharpiks, som opfanger den ammoniak, der dannes som et biprodukt.
Hjertet i reaktionsmekanismen kaldes en dynamisk kinetisk opløsning. Under reaktionen, en chiral hydrazon dannes først som et mellemprodukt i begge enantiomere former. Dette trin er reversibelt, således at begge de enantiomere hydrazoner kan konvertere hinanden i løbet af reaktionen. Reaktionen mellem hydrazonerne og fremstillingen af indolderivaterne er den egentlige katalytiske reaktion. Denne reaktion er meget hurtigere for en af hydrazon-enantiomererne sammenlignet med den anden, fordi den ene form har en mere gunstig geometri, når den binder til den chirale katalysator. Den anden hydrazonenantiomer reagerer meget langsomt og fører kun til en lille mængde af indolproduktet. I stedet, den langsomt reagerende hydrazonenantiomer omdannes til den hurtigt reagerende hydrazonenantiomer, hvilket medfører, at ligevægten til sidst skifter til produktet cyclopentan[b]indol.
Denne metode gjorde det muligt for teamet at producere mange forskellige indolderivater i moderate udbytter, men med god til fremragende enantiomer selektivitet.
 Varme artikler
Varme artikler
-
 Spillets algoritme, der kan forbedre materialedesignKredit:Videnskab og teknologi af avancerede materialer Design af avancerede materialer er en kompleks proces, med mange potentielle kombinationer til præcist at placere atomer i en struktur. Men n
Spillets algoritme, der kan forbedre materialedesignKredit:Videnskab og teknologi af avancerede materialer Design af avancerede materialer er en kompleks proces, med mange potentielle kombinationer til præcist at placere atomer i en struktur. Men n -
 Lysfølsomme E. coli-funktionelle biofilm som stilladser til hydroxyapatitmineraliseringEngineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. Engineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. (a) Skem
Lysfølsomme E. coli-funktionelle biofilm som stilladser til hydroxyapatitmineraliseringEngineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. Engineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. (a) Skem -
 Forskellene i kovalente krystaller og molekylære krystallerKrystallinske faste stoffer indeholder atomer eller molekyler i et gitterdisplay. Kovalente krystaller, også kendt som netværksfaststoffer, og molekylkrystaller repræsenterer to typer krystallinske fa
Forskellene i kovalente krystaller og molekylære krystallerKrystallinske faste stoffer indeholder atomer eller molekyler i et gitterdisplay. Kovalente krystaller, også kendt som netværksfaststoffer, og molekylkrystaller repræsenterer to typer krystallinske fa -
 Brug af en blød krystal til at visualisere, hvordan absorberet kuldioxid opfører sig i væskeDen CO2-absorberende bløde krystal udviklet til denne undersøgelse. Kredit:Shin-ichiro Noro Et team af forskere er lykkedes med at visualisere, hvordan kuldioxid (CO 2 ) opfører sig i en ionisk
Brug af en blød krystal til at visualisere, hvordan absorberet kuldioxid opfører sig i væskeDen CO2-absorberende bløde krystal udviklet til denne undersøgelse. Kredit:Shin-ichiro Noro Et team af forskere er lykkedes med at visualisere, hvordan kuldioxid (CO 2 ) opfører sig i en ionisk
- Grundvandsressourcer i Afrika, der er modstandsdygtige over for klimaændringer
- Grafenlag kan give solceller mulighed for at generere strøm, når det regner
- T. rex havde et unikt fleksibelt kranium
- Ligesom Kina, Japan og USA fortsætter med at finansiere oversøiske kraftteknologier til fossilt br…
- Fakta om Cirrostratus Clouds
- Skovbrande raser i det svulmende Californien


