Ny undersøgelse forklarer Mycobacterium tuberculosis høj resistens over for lægemidler og immunitet
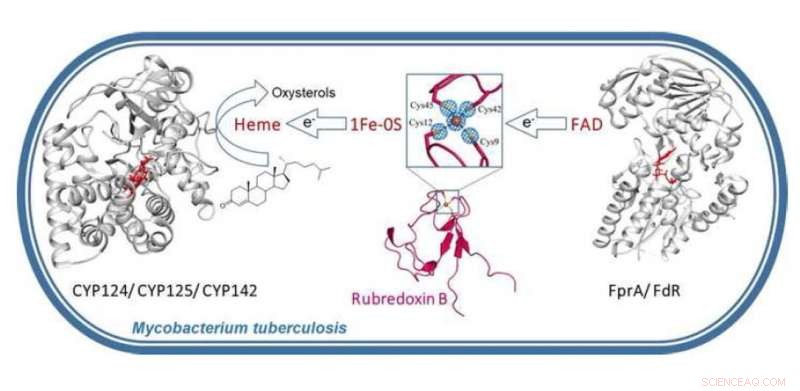
Grafisk abstrakt. Kredit: Bioorganisk kemi (2021). DOI:10.1016/j.bioorg.2021.104721
Et konsortium af forskere fra Rusland, Hviderusland, Japan, Tyskland og Frankrig ledet af en Skoltech-forsker har afsløret den måde, hvorpå Mycobacterium tuberculosis overlever under jernmangeltilstande ved at bruge rubredoxin B, et protein fra en rubredoxinfamilie, der spiller en vigtig rolle i tilpasningen til skiftende miljøforhold. Det nye studie er en del af et forsøg på at studere M. tuberculosis enzymers rolle i udviklingen af resistens over for det menneskelige immunsystem og medicin. Artiklen blev offentliggjort i tidsskriftet Bioorganisk kemi .
Ifølge Verdenssundhedsorganisationen hvert år bliver 10 millioner mennesker syge af tuberkulose og omkring 1,5 millioner dør af det, gør den til verdens bedste smitsomme dræber. Bakterien, der forårsager TB, Mycobacterium tuberculosis, er berygtet for sin evne til at overleve i makrofager, celler i immunsystemet, der ødelægger skadelige bakterier. Fortsat spredning af lægemiddelresistens af M. tuberculosis til udbredt anvendte terapeutika gennem de seneste årtier blev et væsentligt klinisk problem. I denne forbindelse identifikation af nye molekylære lægemiddelmål og dechifrering af de molekylære mekanismer for lægemiddelresistens er af afgørende betydning.
Natallia Strushkevich, Adjunkt ved Skoltech Center for Computational and Data-intensive Science and Engineering (CDISE), og hendes kolleger studerede krystalstrukturen og funktionen af rubredoxin B (RubB), et metalloprotein, der sikrer den korrekte funktion af cytochrom P450 (CYP) proteiner, der er afgørende for bakteriel overlevelse og patogenicitet. Holdet antager, at M. tuberculosis gik over til mere jerneffektiv RubB for at overleve jernsult, når der dannes granulomer (disse er stort set mislykkede forsøg på immunsystemets forsvar mod TB).
"Under den langsigtede co-evolution med pattedyr, M. tuberculosis udviklede en række strategier til at undergrave eller undgå værtens medfødte immunrespons, fra genkendelse af bakterien og fagosomal forsvar i inficerede makrofager, til adaptive immunresponser fra antigenpræsenterende celler.
"Jernassimilation, opbevaring og udnyttelse er afgørende for M. tuberculosis patogenese og også involveret i fremkomsten af multi- og i vidt omfang lægemiddelresistente stammer. Hæm er den foretrukne jernkilde til M. tuberculosis og fungerer som en cofaktor for forskellige metaboliske enzymer. Baseret på vores fund, vi koblede rubredoxin B til hæmmonooxygenaser, der er vigtige for metabolisme af værtsimmunoxysteroler og antituberkulære lægemidler. Vores resultater indikerer, at M. tuberculosis har sit eget xenobiotika-transformationssystem, der ligner humant stofmetaboliseringssystem, " forklarer Natallia Strushkevich.
Ifølge Natallia:Der er stor efterspørgsel efter nye mål for lægemiddeldesign, og cytochrom P450-enzymer er dukket op som nye mål for udvikling af tuberkuloseterapeutiske midler. De klassiske metoder til at blokere disse enzymer er ikke ligetil. At finde den alternative redoxpartner, såsom RubB, muliggør yderligere forståelse af deres funktion i forskellige værtsmikromiljøer. Denne viden kunne udnyttes til at identificere nye måder at blokere deres funktion i M. tuberculosis.
Tidligere forskning fra konsortiet viste, at en af de CYP'er, der er aktiveret af RubB, kan handle mod SQ109, en lovende lægemiddelkandidat mod multiresistent tuberkulose. En anden undersøgelse fokuserede på, hvordan Mycobacterium tuberculosis beskytter sig selv ved at opsnappe menneskelige immunsignalmolekyler - en forhindring, der begrænser opdagelsen af lægemidler.
Sidste artikelMOF datasæt giver 10, 000 strukturer gratis til akademisk forskning
Næste artikelEnantioselektiv syntese af indolderivater
 Varme artikler
Varme artikler
-
 Nye 2-D metal organiske rammer med interessant elektrisk ledningsevne og magnetiske egenskaberFigur 1. Kemisk struktur af jod-dopet Ni (II) tetraaza [14] annulenbundet MOF (NiTAA-MOF). Mens NiTAA-MOF er en isolator, det oxiderede molekyle får elektrisk ledningsevne og paramagnetisme. Kredit:In
Nye 2-D metal organiske rammer med interessant elektrisk ledningsevne og magnetiske egenskaberFigur 1. Kemisk struktur af jod-dopet Ni (II) tetraaza [14] annulenbundet MOF (NiTAA-MOF). Mens NiTAA-MOF er en isolator, det oxiderede molekyle får elektrisk ledningsevne og paramagnetisme. Kredit:In -
 Forskere rapporterer gennembrud i isafvisende materialerForskere fra University of Houston har rapporteret en ny teori i fysik kaldet stresslokalisering, som de brugte til at skabe en holdbar silikonepolymerbelægning, der er i stand til at afvise is fra en
Forskere rapporterer gennembrud i isafvisende materialerForskere fra University of Houston har rapporteret en ny teori i fysik kaldet stresslokalisering, som de brugte til at skabe en holdbar silikonepolymerbelægning, der er i stand til at afvise is fra en -
 Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi
Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi -
 Flygtige overraskelser opstår ved fjernelse af overskydende brintSimulerede krystalstrukturer af jomfru-DEB og T4H-DEB (kemisk kendt som 1, 4-distyrylbenzen, en trans-isomer af DEB-mellemprodukt efter indfangning af første 4 atombrint med 2 CH-bindinger på modsatte
Flygtige overraskelser opstår ved fjernelse af overskydende brintSimulerede krystalstrukturer af jomfru-DEB og T4H-DEB (kemisk kendt som 1, 4-distyrylbenzen, en trans-isomer af DEB-mellemprodukt efter indfangning af første 4 atombrint med 2 CH-bindinger på modsatte
- Teknologi til nedbrydning af bakterier til at bekæmpe lægemiddelresistente superbugs
- Sidelining planlæggere sørger for en fattigere bypolitik, og fremtidige generationer vil betale pr…
- Anvendelse af Colorimeter
- Spider-web labyrinter kan hjælpe med at reducere støjforurening
- Sådan stopper du det ydmyge pindsvin i at forsvinde fra britiske haver og landskab for altid
- Forskning åbner porte for bedre målretning mod stoffer


