Lysfølsomme E. coli-funktionelle biofilm som stilladser til hydroxyapatitmineralisering
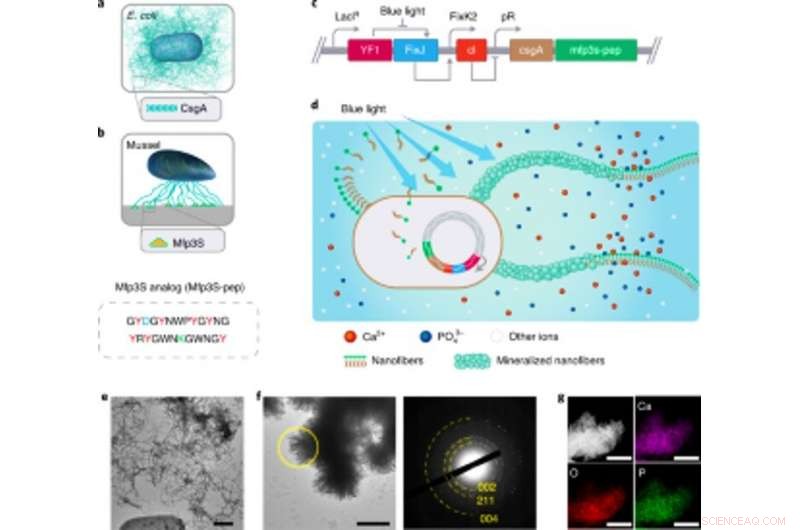
Engineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. Engineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. (a) Skematisk illustration af vildtype E. coli biofilm omfattende ekstracellulære CsgA-amyloid-nanofibre, som er vigtige biofilmproteinkomponenter, der bidrager til robust vedhæftning af biofilm til faste overflader. (b) Skematisk illustration af Mfps fra de selvklæbende plaketter fra Californien musling M. californianus. Mfp3S-pep (nedenfor) er et bioinspireret klæbende peptid, der efterligner det originale Mfp3S-protein, der findes i klæbende plaketter i M. californianus. Mfp3S-pep er beriget med asparaginsyre (blå), lysin (grøn) og tyrosin (rød) rester, kendt for deres funktionelle roller i at fremme nukleationen, vækst og vedhæftning af HA. (c) Skematisk viser de genetiske komponenter i den lys-responsive E. coli biofilm. Designet af funktionelle biofilm blev muliggjort ved at fusionere sekvenser, der koder for CsgA-proteinet og Mfp3S-pep, begge placeret nedstrøms for det lysfølsomme pDawn-transskriptionelle kontrolelement. I pDawn -kredsløbet, det konstitutive udtryk for histidinkinase YF1 og dets beslægtede responsregulator FixJ er stramt reguleret af LacIq -promotoren, mens ekspression af λ fagrepressoren cI styres af FixK2 -promotoren. Ved blålysbelysning, kinase -aktivitet af YF1 og deraf følgende ekspression af cI inhiberes begge, som igen aktiverer λ-promotoren pR for at fremme ekspressionen af CsgA – Mfp3S-pep. (d) Skematisk viser lokal aflejring af HA-mineraler på de funktionelle ekstracellulære nanofibre sammensat af CsgA – Mfp3S-pep-fusionsproteiner, udskilt af manipuleret lysresponsiv E. coli, lightreceiver-CsgA– Mfp3S-pep-stammen. (e) TEM -billede, der viser celler og ekstracellulær matrix med rigelige amyloidfibre i biofilmene. Skala bar, 500 nm. f, TEM-billede, der viser de dannede sammensatte og læg-lignende krystaller, der præcipiterede på overfladerne af ekstracellulære nanofibre efter 7 d mineralisering i 1,5 × SBF. Det tilsvarende SAED -mønster præsenterer diffraktionsbuer, der er tildelt til (002), (211) og (004) fly. Skala bar, 500 nm. g, EDS -kortlægning, der illustrerer Ca, O- og P -elementer tildeles i sagens natur HA -fasen. Målestænger, 500 nm. Kredit: Naturens kemiske biologi , doi:https://doi.org/10.1038/s41589-020-00697-z
Levende organismer har udviklet mekanismer for biomineralisering til at bygge strukturelt ordnede og miljømæssigt adaptive kompositmaterialer. Mens forskerhold har betydeligt forbedret biomimetisk mineraliseringsforskning i laboratoriet, det er stadig svært at konstruere mineraliserede kompositter med strukturelle egenskaber og levende komponenter meget som deres oprindelige modstykker. I en ny rapport nu offentliggjort den Naturens kemiske biologi , Yanyi Wang og et forskerhold i fysik, avancerede materialer, syntetisk biologi, og teknik i Kina, udviklet levende mønstrede og gradientkompositter inspireret af naturlige graderede materialer. De koblede lysinducerbar bakteriel biofilmdannelse med biomimetisk hydroxyapatit (HA) mineralisering i dette arbejde, for at vise, hvordan placeringen og graden af mineralisering kunne kontrolleres. Cellerne i kompositterne forblev levedygtige, mens de registrerede og reagerede på miljøsignaler. Kompositterne viste en 15 gange stigning i Youngs modul (dvs. stivhed, forholdet mellem stress og belastning) efter mineralisering. Værket kaster lys for at udvikle levende kompositter med dynamisk lydhørhed og miljøtilpasningsevne.
Biomineralisering i laboratoriet
Levende organisme kan producere en række hierarkiske organisk-uorganiske sammensatte strukturer baseret på biomineralisering, hvor bemærkelsesværdige eksempler omfatter chitons radular tænder, fiskeskæl og krebsemandler, der opfylder forskellige biologiske funktioner. Tidspunktet og graden af biomineralisering skal kontrolleres præcist af celler for at danne nøjagtige strukturer og funktioner i levende organismer. Nyere forskning inden for biomimetisk mineralisering havde fremhævet vigtigheden af at udforske cellekontrollerede metoder til at producere levende mønstre og graderede kompositter som et lovende, men stort set uudforsket område. Disciplinerne syntetisk biologi og materialevidenskab har frigjort en række sofistikerede og miljøvenlige genkredsløb til bioingeniører en række nye cellulære funktioner. I dette arbejde, Wang et al. udviklet bioinspireret, levende kompositmaterialer ved at udnytte lysinducerbare Escherichia coli biofilm kombineret med biomimetisk mineralisering. Arbejdet åbner døre for at integrere konstruerede celler til fremstilling af mineraliserede materialer med strukturelle og levende egenskaber.
Rumligt kontrollerbar mineralisering af lysinducerbare biofilm til levende mønstrede kompositter. (a) Skematisk af den eksperimentelle opsætning og sekventielle trin til fremstilling af levende mønstrede kompositter. Det blå bladmønster afbildet i illustrationen blev projiceret på en petriskål indeholdende lightreceiver-CsgA – Mfp3S-pep-stammen suspenderet i medium. Blåt lys udløser funktionel biofilmdannelse gennem det lysregulerede udtryk for CsgA – Mfp3S-pep-proteiner fra lightreceiver-CsgA – Mfp3S-pep-stammen. Kulturmediet i petriskålen blev derefter erstattet med 1,5 × SBF, efterfulgt af inkubering ved 37 ° C til dannelse af kompositter. Efter mineraliseringsprocessen, aTc blev tilsat for at inducere ekspressionen af et rødt fluorescerende protein (mCherry). (b) Digitalkamerabillede af de mønstrede biofilm farvet med CV. Skala bar, 1 cm. (c) SEM -billeder, der viser overflademorfologien af de mønstrede biofilm. Målestænger:2 µm (venstre), 1 µm (højre). (d) Digitalkamerabillede af den efterfølgende mineraliserede komposit, der bevarede det originale mønster. Skala bar, 1 cm. (e) SEM -billeder, der viser overflademikrostrukturerne af det mineraliserede komposit. Målestænger:2 µm (venstre), 1 µm (højre). (f, g) Konfokal laserscanningsmikroskopianalyse af bakteriel levedygtighed i biofilm (f) og kompositter (g). Målestænger, 5 µm. Bemærk, at SYTO 9 -farvestof og PI blev anvendt som mærkningsmidler for at plette levende (grønne) og døde (røde) celler, henholdsvis. (h) induceret fluorescens af den levende komposit, der er registreret med et ChemiDoc XRS -system. Skala bar, 1 cm. jeg, Konfokal mikroskopi demonstrerede mCherry -ekspression fra bakterierne i kompositten. Skala bar, 20 µm. j, Konfokale billeder af en levende komposit efter inducering af mCherry -ekspression og mærkning med calcein, som angav en homogen fordeling af organiske komponenter og uorganiske mineraler inde i de mønstrede levende kompositter. Målestænger, 20 µm. Kredit: Naturens kemiske biologi , doi:https://doi.org/10.1038/s41589-020-00697-z 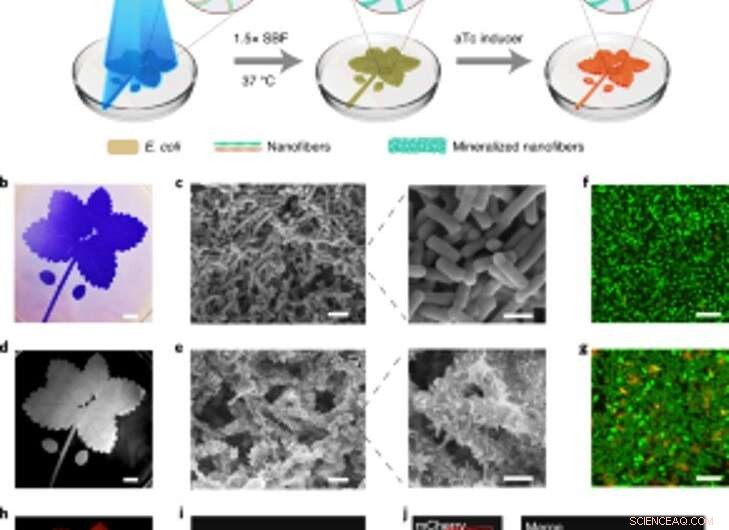
Teamet valgte fusionsproteiner til at konstruere mineralisering, der fremmer E. coli biofilm. Baseret på tidligere forsøg, de valgte protein Mefp5 - stammer fra Mytilus edulis, efterfulgt af Mfp3S-stammer fra Mytilus californianus og en anden variant af Mfp3S-peptidet (Mfsp3S-pep) for at starte mineralisering og fremme vedhæftning. Teamet konstruerede fusionsproteiner indeholdende et stort proteindomæne i E. coli biofilmen til dannelse af CsgA-Mfp fusionsproteiner og bekræftede deres potentielle sekretion fra manipulerede celler. De valgte derefter CsgA – Mfp3S-pep-fusionsproteinet som repræsentant for hydroxyapatitmineralisering og udførte eksperimenter for at verificere proteinets funktion for at fremhæve deres rolle under mineralisering og krystaldannelse. Derefter, Wang et al. konstrueret en lysinducerbar biofilmdannende stamme, der hed lys modtager -CsgA-Mfp3S-pep, der kan reguleres tæt via blåt lys.
Den lysfølsomme stamme kunne generere funktionelle biofilm materialer efter belysning med lys for at fremme mineraliseringen af hydroxyapatit (HA). For at validere dette, forskerne udsatte den lysfølsomme stamme for blåt lys i en petriskål og brugte histologisk farvning og transmissionselektronmikroskopi (TEM) til at vise produktionen af amyloidfibre i biofilmene. Forholdsvis de observerede ikke amyloidfibre i prøver dyrket i mørket. Den konstruerede ekstracellulære matrix fungerede også som en skabelon for HA -mineralisering i tide, som de bekræftede efter 7-dages inkubation baseret på røntgendiffraktion (XRD) og energidispersiv røntgenspektroskopi (EDS) teknikker.
Tæthedskontrollerbar mineralisering i lysintensitetsregulerede gradientbiofilm, der bruges til at fremstille levende sorterede kompositter. (a) Skematisk illustration, der viser dannelsen af levende gradientkompositter gennem in situ mineralisering af biofilm med gradientbiomassetætheder. Gradientbiofilmene blev dannet ved at projicere lys med varierende intensiteter og præcis rumlig kontrol på petriskålen indeholdende lightreceiver-CsgA-Mfp3S-pep-stammen suspenderet i medium. (b) Digitalkamerabillede, der viser CV-farvede biofilm med gradientbiomassetætheder. Skala bar, 1 cm. (c) Digital kamerabillede af efterfølgende dannede gradient levende kompositter efter HA -mineralisering. Skala bar, 1 cm. (d) Tykkelsen af biofilm og de efterfølgende mineraliserede kompositter dannet under forskellige lysintensiteter. Resultaterne præsenteres som middelværdi ± s.d. Data er repræsentative for n =5 uafhængige eksperimenter. (e) SEM-mikrografer i sektion, der viser forskellige regioners morfologier (A1 – A4) i de lysintensitetsgraderede biofilm. Målestænger, 10 µm. Det indsatte billede (taget fra A4 -regionen) repræsenterer den typiske overflademorfologi for biofilm. Skala bar, 1 µm. (f) Sektionelle SEM-mikrografer, der viser morfologierne i forskellige regioner (B1 – B4) i de levende gradientkompositter som skabelon af lysintensitetsgraderede biofilm stilladser. Målestænger, 10 µm. Det indsatte billede (taget fra B4 -regionen) repræsenterer den typiske overflademorfologi for de mineraliserede gradientkompositter. Skala bar, 1 µm. Bemærk, at uigennemsigtighedsprocenten er 100%, 50%, 25% og 12,5% svarer til den faktiske lysintensitet på 0,0306 W cm − 2, 0,0268 W cm − 2, 0,0178 W cm − 2 og 0,0140 W cm − 2, henholdsvis. Kredit: Naturens kemiske biologi , doi:10.1038/s41589-020-00697-z 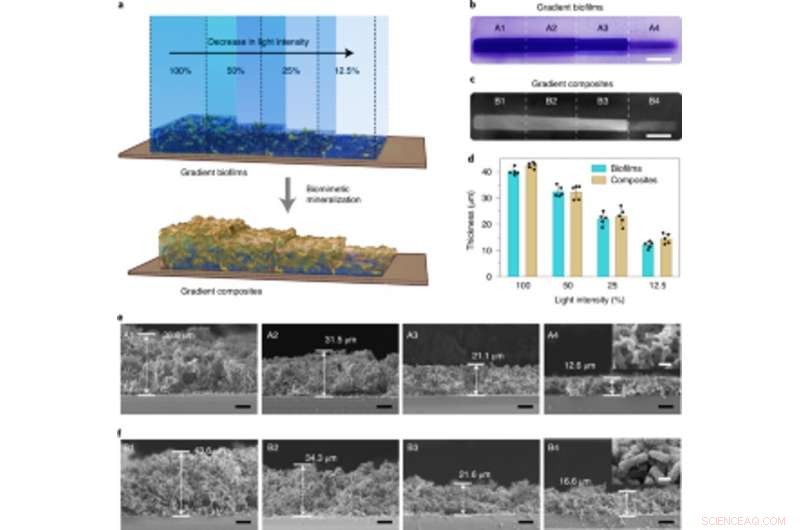
Baseret på den lysfølsomme karakter af de konstruerede biofilm, Wang et al. manipuleret biofilmdannelse i rumtid for at kontrollere dannelsen af kompositter. De opnåede dette ved at belyse et bladmønster på flydende bakteriekulturer i polystyren petriskåle, der trofast recapitulerede det projicerede lysmønster på de bakterielle biofilm. Efter 7 dages mineralisering, kompositten genereret i petriskålene bevarede det originale mønster som observeret ved anvendelse af scanningselektronmikroskopi. Den lysregulerede tilgang kontrollerede komposittens form baseret på gittermønsterprojektioner og rumlig opløsning af lys i mikroskalaen-sammenlignelig med størrelsen af de levende bakterier. Holdet bekræftede derefter levedygtigheden af live, intakte celler ved at konstruere de levende kompositter til at udtrykke fluorescerende proteiner, som bekræftet ved hjælp af konfokalmikroskopibilleder. Derefter, de brugte termogravimetrisk analyse til at kvantificere de uorganiske komponenter i mineraliserede kompositter, hvor det uorganiske materiale steg proportionalt med tiden ved nedsænkning i simuleret kropsvæske (SBF). Wang et al. sammenlignede også Youngs modul for biofilmen ved hjælp af en mikroindrykningsteknik for at vise, hvordan mineralisering styrker E. coli biofilmene for at beskytte cellerne.
Tæthedskontrollerede gradientkompositter
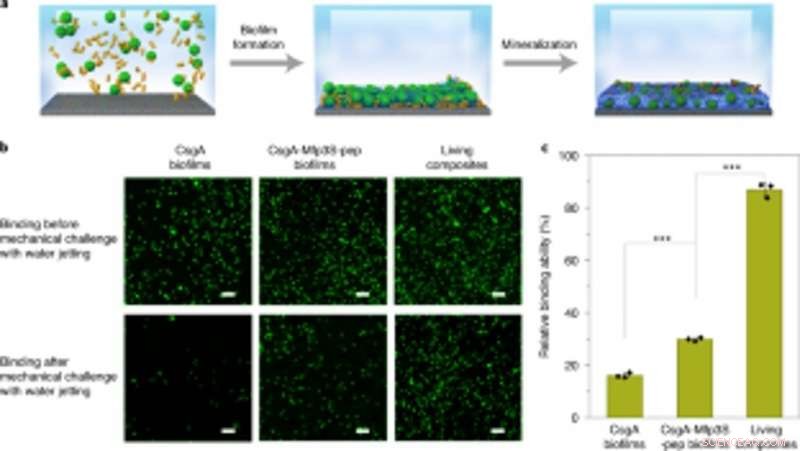
Kobling konstruerede biofilm med mineralisering til robust optagelse og immobilisering af mikrosfærer på underlag. (a) Skematisk viser opsamling og immobilisering af mikrosfærer på et glasglas i opløsning. PS -mikrosfærer suspenderet i dyrkningsmedium blev fanget og immobiliseret på et substrat gennem biofilmdannelse efterfulgt af mineralisering i 1,5 × simuleret kropsvæske (SBF). (b) Fluorescerende billeder, der viser de to typer biofilm (venstre og midtersøjler) og levende komposit-immobiliserede mikrosfærer (højre kolonne) på substraterne før (top) og efter (bund) udfordring med vandstråle ved et konstant udledningstryk på 8 psi. Målestænger, 100 µm. (c) Kvantificering af de relative muligheder for forskellige biofilm og levende kompositter til at lime og immobilisere PS -mikrosfærer på substratet. Resultaterne præsenteres som middelværdi ± s.d. Fra venstre til højre:P =0,00003, P =0,000004. *S <0,05, ** S <0,01, *** P <0,001. Statistik udledes ved hjælp af en tosidet t-test. Data er repræsentative for n =3 uafhængige eksperimenter. Kredit: Naturens kemiske biologi , doi:https://doi.org/10.1038/s41589-020-00697-z
Tissue engineering -tilgange har understreget behovet for præcist at identificere mellem hårdt og blødt væv for en vellykket fysiologisk ydeevne, derfor kunne lysintensiteten indstilles til at kontrollere tætheden og de mekaniske egenskaber ved konstruerede levende materialer. Zhang et al. opnået dette ved at udsætte E. coli -kulturer for forskellige lysintensiteter for at afsløre, hvordan biofilmtykkelsen faldt med den faldende intensitet af blåt lys. De viste yderligere, hvordan mineralisering blev stramt og lokalt styret af de konstruerede Mfsp3S-pep-fusionsproteiner. Derefter studerede de de lokale mekaniske egenskaber for belyste områder med mikroindrykning for at observere en firdobling i Youngs modul for at fremhæve levende kompositter konstrueret med afstembare mineralgradienter og mekaniske egenskaber til regenerative væv-til-knogle-grænseflader i knoglevævstekniske applikationer.
Implementering af levende kompositter til reparation af stedsspecifikke skader
Forskerne undersøgte også kapaciteten for de konstruerede biofilm til at aggregere for reparation af skader ved at lime polystyrenmikrosfærer, ved siden af HA-mineralisering. Som bevis-på-koncept, de påførte levende mineraliserede kompositter til at fylde og reparere revner konstrueret på overfladen af en polystyren petriskål. Under forsøgene, de lysinducerede klæbende biofilm fangede mikrosfærer i opløsning for at fylde den med vilje skabte beskadigede fure, mens nanofibre i biofilm fungerede som en skabelon for hydroxyapatitmineralisering for at konsolidere lysinduceret cementering under blålysbelysning. Brug af scanningselektronmikroskopi, Wang et al. viste, hvordan bakterier og den omgivende ekstracellulære matrix klæbte sammen med mikrosfærer for at illustrere de levende biofilmers klæbende funktion. De HA-mineraliserede kompositter dannede tætte, betonlignende lag, der lagde den beskadigede fure for at fremhæve mineraliseringsfunktionaliteten af de levende kompositter for øget holdbarhed og reparationsapplikationer.
Anvendelse af styrbar levende mineralisering til stedsspecifikke skadereparationer. (a) Skematisk visning af anvendelse af levende mineraliserede kompositter til fyldning og reparation af revner på overfladen af en PS petriskål. Fra venstre til højre:beskadigelse af furen på petriskålens underlag, lysinducerede klæbende biofilm fanger mikrosfærer i opløsning for at fylde skadefuren, og nanofibre i biofilm fungerer som en skabelon for HA -mineralisering til at konsolidere cementen. (b) SEM -billede, der viser skadesfuren. Under, et skematisk diagram, der illustrerer målene på skadefuren. Skala bar, 50 µm. c, SEM -billeder, der viser morfologien for skadefuren fyldt med biofilm og mikrosfærer. Målestænger:50 µm (øverst), 5 µm (bund). (d) SEM -billeder, der viser morfologien for skadefuren efter mineralisering; HA udfylder hullerne mellem kugler. Målestænger:50 µm (øverst), 5 µm (bund). Bemærk, at de stedsspecifikke skadereparerende forsøg blev gentaget mindst tre gange med identiske resultater. Kredit: Naturens kemiske biologi , doi:10.1038/s41589-020-00697-z 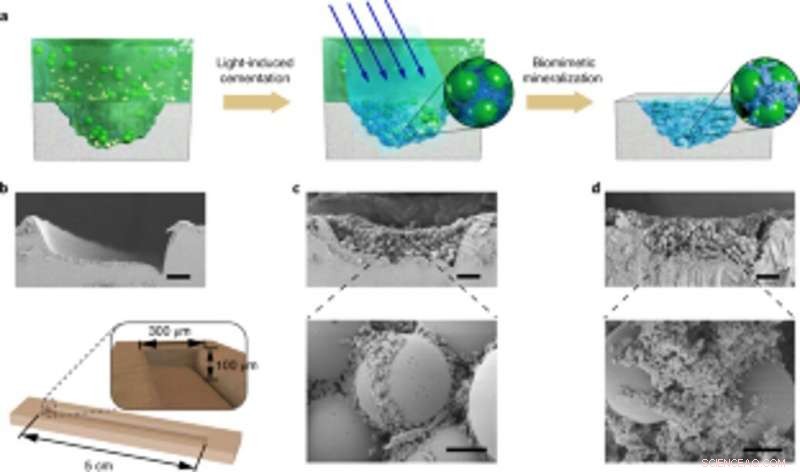
På denne måde, Yanyi Wang og kolleger producerede bioinspirerede levende mønstrede kompositmaterialer og levende graderede kompositter med en lysreguleret biofilmplatform. De resulterende kompositter viste miljøresponsivitet svarende til deres indfødte modparter. Cellerne i kompositterne forblev levedygtige og reagerede på miljøstimuleringer, selv efter mineralisering. Værket åbner en vej til at skabe liv, funktionelle organisk-uorganiske kompositter med adaptive og selvreparerende funktioner med anvendelser på tværs af biomedicin, regenerativ medicin, og bioremediering.
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Innovativ model skabt til NASA til at forudsige vitaminniveauer i rumflyvningsmadUMass Amherst professor i fødevarevidenskab. Kredit:UMass Amherst Et hold af fødevareforskere ved University of Massachusetts Amherst har udviklet en banebrydende, brugervenlig matematisk model fo
Innovativ model skabt til NASA til at forudsige vitaminniveauer i rumflyvningsmadUMass Amherst professor i fødevarevidenskab. Kredit:UMass Amherst Et hold af fødevareforskere ved University of Massachusetts Amherst har udviklet en banebrydende, brugervenlig matematisk model fo -
 Solcelledrevet fugtoptager opsamler og renser vand fra luftenKredit:CC0 Public Domain Adgang til rent vand er fortsat en af de største udfordringer, som menneskeheden står over for. Et gennembrud af ingeniører ved University of Texas i Austin kan tilbyde
Solcelledrevet fugtoptager opsamler og renser vand fra luftenKredit:CC0 Public Domain Adgang til rent vand er fortsat en af de største udfordringer, som menneskeheden står over for. Et gennembrud af ingeniører ved University of Texas i Austin kan tilbyde -
 Mærkning af proteiner med ubiquitin baner ny vej til forskning i cellereguleringForskerne udstyrede et cellulært protein (gråt) med en modificeret lysinaminosyre byggesten (lyserød), hvortil det bakterielle enzym sortase (gul) transmitterer et ubiquitinmolekyle (blåt). Kredit:K.
Mærkning af proteiner med ubiquitin baner ny vej til forskning i cellereguleringForskerne udstyrede et cellulært protein (gråt) med en modificeret lysinaminosyre byggesten (lyserød), hvortil det bakterielle enzym sortase (gul) transmitterer et ubiquitinmolekyle (blåt). Kredit:K. -
 Fremtidige biler kan fremstilles af revolutionerende nyt materialeKredit:CC0 Public Domain Et nyt materiale, der er så stift som metal, men fleksibelt nok til at modstå kraftige vibrationer, kan forvandle bilindustrien, siger eksperter fra University of Surrey.
Fremtidige biler kan fremstilles af revolutionerende nyt materialeKredit:CC0 Public Domain Et nyt materiale, der er så stift som metal, men fleksibelt nok til at modstå kraftige vibrationer, kan forvandle bilindustrien, siger eksperter fra University of Surrey.
- Smart, selvdrevne knæimplantater kan reducere antallet af knæudskiftningsoperationer
- Ny udvikling inden for nanoteknologi tackler de to største problemer forbundet med kemoterapi
- Nanotræer høster solens energi for at omdanne vand til brintbrændstof
- Nanofabrikation:Medicinske sensorer forbedres med hullede guld -nanostrukturer
- ATLAS rapporterer første observation af WWW-produktion
- Mercury Transfer Module solcellefløj implementering


