Er opløselighed den samme for forskellige temperaturer i opløsningsmiddel?
Her er hvorfor:
* Temperatur og kinetisk energi: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Når temperaturen stiger, bevæger molekyler sig hurtigere og har mere energi.
* Breaking intermolekylære kræfter: For at et opløst stof skal opløses, skal de intermolekylære kræfter mellem dens molekyler (og opløsningsmiddelmolekylerne) brydes. Øget kinetisk energi gør det lettere at bryde disse kræfter.
* Øget opløsning: Med øget kinetisk energi kan flere opløste molekyler interagere med opløsningsmiddelmolekylerne, hvilket fører til større opløselighed.
Generelle tendenser:
* faste stoffer: Opløselighed af de fleste faste stoffer i væsker øges med temperaturen. Tænk på sukker, der opløses hurtigere i varmt vand end koldt vand.
* Gasser: Opløselighed af gasser i væsker falder med temperaturen. Forestil dig at åbne en flaske soda. Flere gasudslip (opløser mindre) i varm soda end kold soda.
Undtagelser: Der er nogle undtagelser fra disse generelle tendenser, men de er mindre almindelige.
Kortfattet: Temperatur spiller en betydelig rolle i opløselighed. Jo højere temperatur er, desto mere sandsynligt er et opløst stof at opløses i et opløsningsmiddel (med nogle undtagelser).
 Varme artikler
Varme artikler
-
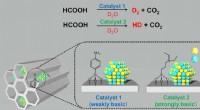 Nanokatalysator gør tungt arbejde af myresyreKontrolleret frigivelse af hydrogenisotopforbindelser fra dehydrogeneringen af myresyre i D 2 O af PdAg-legeringens nanopartikler understøttet på aminfunktionaliseret silica. Kredit:Osaka Universi
Nanokatalysator gør tungt arbejde af myresyreKontrolleret frigivelse af hydrogenisotopforbindelser fra dehydrogeneringen af myresyre i D 2 O af PdAg-legeringens nanopartikler understøttet på aminfunktionaliseret silica. Kredit:Osaka Universi -
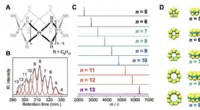 En forberedende reaktion ved hjælp af platinklynger med en encifret atomicitet realiseretFigur (A) viser kompleksernes kemiske struktur, (B) viser kromatogrammet for HPLC -adskillelsen med størrelsesekskluderingskolonner, (C) viser MALDI-TOF-massespektre for de isolerede platinkomplekser
En forberedende reaktion ved hjælp af platinklynger med en encifret atomicitet realiseretFigur (A) viser kompleksernes kemiske struktur, (B) viser kromatogrammet for HPLC -adskillelsen med størrelsesekskluderingskolonner, (C) viser MALDI-TOF-massespektre for de isolerede platinkomplekser -
 Forskere opdager metode til at kontrollere kræftfremkaldende formaldehydfrigivelse fra træ i hjemm…Kredit:Unsplash/CC0 Public Domain Ny forskning, ledet i fællesskab af University of Massachusetts Amherst og University of North Texas, fremmer vores forståelse af, hvordan træet i vores hjem og ko
Forskere opdager metode til at kontrollere kræftfremkaldende formaldehydfrigivelse fra træ i hjemm…Kredit:Unsplash/CC0 Public Domain Ny forskning, ledet i fællesskab af University of Massachusetts Amherst og University of North Texas, fremmer vores forståelse af, hvordan træet i vores hjem og ko -
 Teknik fremskynder kemisk screening for at prioritere toksicitetstestKredit:North Carolina State University Forskere fra North Carolina State University har udviklet en teknik med høj kapacitet, der kan afgøre, om et kemikalie har potentiale til at aktivere nøglege
Teknik fremskynder kemisk screening for at prioritere toksicitetstestKredit:North Carolina State University Forskere fra North Carolina State University har udviklet en teknik med høj kapacitet, der kan afgøre, om et kemikalie har potentiale til at aktivere nøglege
- Sammenligning af flaskehalseffekten og grundlæggernes effekt
- Hvad har kærlighed med det at gøre? Meget for at aflytte flagermus, synge katyider
- Forskere introducerer ny metode til maskinlæringsklassifikationer i kvanteberegning
- Hvorfor er mel en fast og ikke flydende eller gas?
- Hvor ionisk:Stilladser har ansvaret for calciumcarbonatkrystaller
- Hvad er jobbet med nuklear?


