Hvilken gas er i overensstemmelse med lovene under alle betingelser for temperatur og tryk?
Her er hvorfor:
* Ideelle antagelser om gasret: Den ideelle gaslov er baseret på følgende antagelser:
* Gasmolekyler har ubetydelig volumen.
* Gasmolekyler interagerer ikke med hinanden (ingen attraktive eller frastødende kræfter).
* Ægte gasadfærd: Ægte gasser afviger fra ideel opførsel, fordi:
* molekylær volumen: Ved høje tryk bliver volumenet, der er optaget af gasmolekyler, signifikant sammenlignet med det samlede volumen, hvilket ugyldiggør den ubetydelige volumenantagelse.
* Intermolekylære kræfter: Ved lave temperaturer bliver intermolekylære kræfter mere fremtrædende, hvilket får molekyler til at tiltrække hinanden og afvige fra ideel opførsel.
Imidlertid kommer nogle gasser tættere på ideel adfærd under visse betingelser:
* Lavt tryk: Ved lavt tryk er volumenet, der er optaget af gasmolekyler, meget mindre end det samlede volumen, og intermolekylære kræfter er svagere.
* Høj temperatur: Ved høje temperaturer overvinder den kinetiske energi af molekyler intermolekylære kræfter.
Derfor er den ideelle gaslov en god tilnærmelse for reelle gasser under betingelser med lavt tryk og høj temperatur. Men det er vigtigt at huske, at ingen gas opfører sig perfekt ideelt på alle forhold.
 Varme artikler
Varme artikler
-
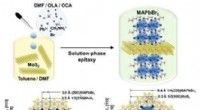 Ukonventionel løsningsproces til 2-D heterostrukturSkematisk model af MAPbBr3 || MoS2 epitaksialt forhold. Kredit:Science China Press Opløsningsforarbejdede overgangsmetalchalcogenid (TMD) nanosheets udviser begrænset lysabsorption og lav kvanteef
Ukonventionel løsningsproces til 2-D heterostrukturSkematisk model af MAPbBr3 || MoS2 epitaksialt forhold. Kredit:Science China Press Opløsningsforarbejdede overgangsmetalchalcogenid (TMD) nanosheets udviser begrænset lysabsorption og lav kvanteef -
 Mindre salt, mere protein:Adressering af mejeriprocesser miljømæssigt, bæredygtighedsspørgsmålEn grafisk fremstilling af den nye valleforarbejdningsmetode. Kredit:Xiao Su Forskere siger, at det høje saltindhold i valle - den vandige del af mælk, der efterlades efter ostfremstilling - er me
Mindre salt, mere protein:Adressering af mejeriprocesser miljømæssigt, bæredygtighedsspørgsmålEn grafisk fremstilling af den nye valleforarbejdningsmetode. Kredit:Xiao Su Forskere siger, at det høje saltindhold i valle - den vandige del af mælk, der efterlades efter ostfremstilling - er me -
 Kunstig fotosyntese får et stort løft fra ny katalysatorPhil De Luna er en af hovedforfatterne til et nyt papir offentliggjort i Nature Chemistry, der rapporterer en lavpris, højeffektiv katalysator til kemisk omdannelse af vand til oxygen. Katalysatoren
Kunstig fotosyntese får et stort løft fra ny katalysatorPhil De Luna er en af hovedforfatterne til et nyt papir offentliggjort i Nature Chemistry, der rapporterer en lavpris, højeffektiv katalysator til kemisk omdannelse af vand til oxygen. Katalysatoren -
 Cellulose til fremstilling af avancerede materialerErlantz Lizundia – Fernandez. Kredit:UPV/EHU. Det sidste årti har oplevet en stigning i videnskabelige publikationer og patenter på cellulose, den mest almindelige naturlige polymer. Ved at gennem
Cellulose til fremstilling af avancerede materialerErlantz Lizundia – Fernandez. Kredit:UPV/EHU. Det sidste årti har oplevet en stigning i videnskabelige publikationer og patenter på cellulose, den mest almindelige naturlige polymer. Ved at gennem
- Gennemsnitlige mennesker kan gøre en forskel på globale udfordringer, siger forsker
- Ny model uddyber forståelsen af dynamikken i kvark-gluonplasmaer
- Adlyder alle netværk loven om skalafri? Måske ikke
- Ultrahurtige laserimpulser møder magnetiske materialer i ny forskning
- Optimering af fodring er nødvendig for at opretholde mælkeproduktionen i økologiske besætninger
- Har du brug for at give tip til din Uber-chauffør?


