Hvad er de tre typer kemiske bindinger?
1. ioniske bindinger: Disse bindinger dannes, når et atom overfører en eller flere elektroner fuldstændigt til et andet atom. Dette resulterer i dannelsen af ioner (ladede atomer), der tiltrækkes af hinanden på grund af deres modsatte afgifter. Tænk på bordsalt (NaCl) som et eksempel.
2. kovalente obligationer: I denne type binding deler to atomer et eller flere par elektroner. Denne deling skaber en mere stabil elektronkonfiguration for begge atomer. Vand (H₂O) er et godt eksempel.
3. Metalliske obligationer: Denne type binding forekommer mellem metalatomer. I en metallisk binding delokaliseres valenselektronerne i metalatomerne, hvilket betyder, at de er frie til at bevæge sig gennem hele metalstrukturen. Dette skaber et hav af elektroner, der holder de positivt ladede metalioner sammen. Tænk på en kobbertråd.
Det er vigtigt at bemærke, at der er andre typer bindinger som hydrogenbindinger, van der Waals -styrker og koordinere kovalente bindinger. Disse klassificeres ofte som svagere interaktioner sammenlignet med de tre primære typer.
Sidste artikelHvorfor er kviksølv et rent stof?
Næste artikelHvor beregner PH for en løsning?
 Varme artikler
Varme artikler
-
 Svampe, fjer kombineres i biologisk nedbrydelige skoTo University of Delaware-studerende har lavet en biologisk nedbrydelig sko ved hjælp af svampe, kyllingefjer og tekstilaffald. Prototypeskoen består af en myceliumbaseret sål, dækket med vegansk læde
Svampe, fjer kombineres i biologisk nedbrydelige skoTo University of Delaware-studerende har lavet en biologisk nedbrydelig sko ved hjælp af svampe, kyllingefjer og tekstilaffald. Prototypeskoen består af en myceliumbaseret sål, dækket med vegansk læde -
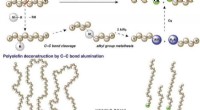 Plast kunne se et andet liv som biologisk nedbrydelige overfladeaktive stofferLange carbonhydridkæder af polymerer opdeles i kortere enheder med introduktionen af endegrupper af aluminium. Kredit:US Department of Energy, Ames Laboratorium Forskere ved Institute for Cooper
Plast kunne se et andet liv som biologisk nedbrydelige overfladeaktive stofferLange carbonhydridkæder af polymerer opdeles i kortere enheder med introduktionen af endegrupper af aluminium. Kredit:US Department of Energy, Ames Laboratorium Forskere ved Institute for Cooper -
 Gør mere plast genanvendeligtDIMOP-projektet har til formål at udvikle digitale værktøjer til nemt at bestemme og forbedre genanvendeligheden af plastprodukter, for eksempel, ved at reducere antallet af materialekomponenter. Kr
Gør mere plast genanvendeligtDIMOP-projektet har til formål at udvikle digitale værktøjer til nemt at bestemme og forbedre genanvendeligheden af plastprodukter, for eksempel, ved at reducere antallet af materialekomponenter. Kr -
 Iagttager en skiftende platinelektrodeKredit:Leiden University Overfladen på platinelektroder ændrer sig meget mere under brug end tidligere antaget. I et samarbejde mellem Leiden Institutes of Chemistry and Physics, kemikere Leon Jac
Iagttager en skiftende platinelektrodeKredit:Leiden University Overfladen på platinelektroder ændrer sig meget mere under brug end tidligere antaget. I et samarbejde mellem Leiden Institutes of Chemistry and Physics, kemikere Leon Jac
- Optrævling af tørkedilemmaet i Sydkorea:Kan reservoirer være en kulstofkilde?
- Hvordan hjælper Marijuana folks sundhed
- Hvordan kan en raket bevæge sig gennem det ydre rum, hvor uanset eksisterer det for at skubbe på?
- Kvindelige forskere udgiver anbefalinger til børnepasning til konferencearrangører
- En Saturn-månes slingren antyder, hvad der ligger nedenunder
- Gennembrud i søgen efter grafen-baseret elektronik


