Hvad indikerer et produktkonstant med lav opløselighed i forbindelse med forbindelse?
Her er hvorfor:
* opløselighedsproduktkonstant (KSP) Repræsenterer ligevægtskonstanten for opløsning af en sparsomt opløselig ionisk forbindelse i vand. Det afspejler, i hvilket omfang forbindelsen opløses og danner dens bestanddele.
* en lav KSP -værdi betyder, at produktet af ionkoncentrationerne i den mættede opløsning er lille. Dette indebærer, at kun en lille mængde af forbindelsen opløses, før opløsningen bliver mættet, hvilket resulterer i en lav opløselighed.
i enklere termer: Forestil dig en forbindelse som sand i vand. Hvis det har en lav KSP, er det som om, at sandet næppe opløses, hvilket efterlader det meste som solidt i bunden af beholderen.
Her er nogle nøglepunkter:
* En mindre KSP -værdi betyder en lavere opløselighed.
* En større KSP -værdi betyder en højere opløselighed.
Eksempler:
* Sølvchlorid (AgCl) har en meget lav KSP (1,8 x 10⁻¹⁰), hvilket indikerer, at det næsten er uopløseligt i vand.
* Calciumcarbonat (Caco₃) har en KSP på 4,8 x 10⁻⁹, hvilket indikerer, at det også er relativt uopløseligt.
* Natriumchlorid (NaCl) har en meget høj KSP, hvilket gør det meget opløseligt i vand.
Konklusion , en lav KSP er en direkte indikator for lav opløselighed, hvilket betyder, at forbindelsen ikke let opløses i vand.
 Varme artikler
Varme artikler
-
 Hvordan fiskeskind og alger kunne hjælpe med at løse plastikforureningskrisenProduktdesignstuderende Lucy Hughes har opfundet en bioplast skabt af fiskeskind og skæl og røde alger. Kredit:University of Sussex En studerende fra University of Sussex har hentet inspiration fr
Hvordan fiskeskind og alger kunne hjælpe med at løse plastikforureningskrisenProduktdesignstuderende Lucy Hughes har opfundet en bioplast skabt af fiskeskind og skæl og røde alger. Kredit:University of Sussex En studerende fra University of Sussex har hentet inspiration fr -
 Kemikere rapporterer om en ny anvendelse af affaldsproduktet fra atomkraftproduktionKredit:CC0 Public Domain Kemikere har fundet en ny anvendelse for affaldsproduktet fra atomkraft - ved at omdanne et ubrugt lager til en alsidig forbindelse, som kan bruges til at skabe værdifulde
Kemikere rapporterer om en ny anvendelse af affaldsproduktet fra atomkraftproduktionKredit:CC0 Public Domain Kemikere har fundet en ny anvendelse for affaldsproduktet fra atomkraft - ved at omdanne et ubrugt lager til en alsidig forbindelse, som kan bruges til at skabe værdifulde -
 Tellurium gør forskellenProfessor Wolfgang Weigand fra det tyske universitet i Jena viser usædvanlige strukturer af tellurforbindelser. Kredit:Anne Günther/Uni Jena Det periodiske system indeholder 118 kemiske grundstoff
Tellurium gør forskellenProfessor Wolfgang Weigand fra det tyske universitet i Jena viser usædvanlige strukturer af tellurforbindelser. Kredit:Anne Günther/Uni Jena Det periodiske system indeholder 118 kemiske grundstoff -
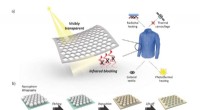 Ny nanofotonisk belægning kunne hjælpe med termisk styring og modovervågninga) Skematisk af VTIR for at blokere emissionen af termisk stråling til strålingsopvarmning og termisk camouflage. b) Skematisk fremstilling af fremstillingsprocessen og SEM-billeder for VTIR-belægni
Ny nanofotonisk belægning kunne hjælpe med termisk styring og modovervågninga) Skematisk af VTIR for at blokere emissionen af termisk stråling til strålingsopvarmning og termisk camouflage. b) Skematisk fremstilling af fremstillingsprocessen og SEM-billeder for VTIR-belægni
- Fjern blokering af nøgen Venus:Facebook OK muse -nøgenbilleder
- Nye filtre kunne gøre producenterne i stand til at udføre meget selektiv kemisk adskillelse, reduc…
- Hvad er den kemiske formel for fugtighedscreme?
- Spillere kan hjælpe forskere med at jage efter rigtige eksoplaneter i EVE Online
- Hvilken struktur skal enzymer bryde?
- Hvorfor er din penny fra 1955 lavet af tin?


