Hvordan danner alkalimetaller forbindelser?
1. Ioniske forbindelser:
* reaktion med ikke -metaller: Alkalimetaller reagerer kraftigt med ikke -metaller som halogener (fluor, klor, brom, iod) for at danne ioniske forbindelser. Alkali -metallet mister sin valenselektron for at blive en positivt ladet ion (kation), mens ikke -metalen får elektronet til at blive en negativt ladet ion (anion).
* Eksempel: Natrium (NA) reagerer med chlor (CL) for at danne natriumchlorid (NaCI).
* Ligning: 2na + cl₂ → 2naCl
* reaktion med vand: Alkalimetaller reagerer voldsomt med vand, frigiver brintgas og danner et metalhydroxid. Reaktionen er eksoterm, hvilket betyder, at den frigiver varme.
* Eksempel: Lithium (Li) reagerer med vand til dannelse af lithiumhydroxid (LioH).
* Ligning: 2LI + 2H₂O → 2LIOH + H₂
2. Kovalente forbindelser:
* sjælden forekomst: Alkalimetaller danner typisk ioniske forbindelser på grund af deres stærke tendens til at miste elektroner. De kan imidlertid danne kovalente bindinger med stærkt elektronegative elementer, såsom ilt i peroxider.
* Eksempel: Natrium (NA) reagerer med ilt (O₂) for at danne natriumperoxid (Na₂o₂).
* Ligning: 2na + o₂ → na₂o₂
Nøglepunkter:
* reaktivitet: Alkalimetaller er meget reaktive på grund af deres tendens til at miste deres valenselektron.
* ionisk binding: Alkalimetaller danner primært ioniske bindinger med ikke -metaller.
* Oxidation siger: Alkalimetaller har altid en +1 oxidationstilstand i deres forbindelser.
* eksotermiske reaktioner: Reaktioner af alkalimetaller er ofte eksoterme, hvilket frigiver betydelige mængder energi.
Kortfattet: Alkalimetaller danner forbindelser primært gennem ionisk binding, mister deres enkelt valenselektron til dannelse af +1 kationer og reagerer med ikke -metaller til dannelse af ioniske forbindelser. De kan også danne kovalente forbindelser i sjældne tilfælde.
Sidste artikelFormål med at tilføje NaOH til blandingen, før de tager polarimeterlæsning?
Næste artikelHar H2O og H2O2 de samme egenskaber?
 Varme artikler
Varme artikler
-
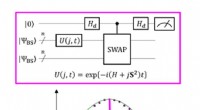 Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit
Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit -
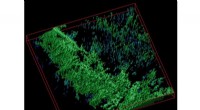 Forskere udvikler et cellulosebiosensormateriale til avanceret vævsteknologiEn 3D-rekonstruktion af en cellulosematrix farvet med en pH-følsom biosensor. Kredit:Dr. R. Dmitriev I.M. Sechenov fra First Moscow State Medical University gik sammen med irske kolleger for at ud
Forskere udvikler et cellulosebiosensormateriale til avanceret vævsteknologiEn 3D-rekonstruktion af en cellulosematrix farvet med en pH-følsom biosensor. Kredit:Dr. R. Dmitriev I.M. Sechenov fra First Moscow State Medical University gik sammen med irske kolleger for at ud -
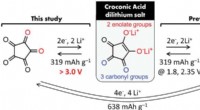 Et 4 V-klasse metalfrit organisk lithium-ion-batteri kommer tættere på virkeligheden3,0 V. Kredit:Advanced Science (2022). DOI:10.1002/advs.202200187 Et fælles forskerhold fra Tohoku University og University of California, Los Angeles (UCLA) har gjort et betydeligt fremskridt hen
Et 4 V-klasse metalfrit organisk lithium-ion-batteri kommer tættere på virkeligheden3,0 V. Kredit:Advanced Science (2022). DOI:10.1002/advs.202200187 Et fælles forskerhold fra Tohoku University og University of California, Los Angeles (UCLA) har gjort et betydeligt fremskridt hen -
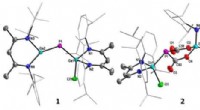 Fremtidige muligheder for lagring af kuldioxid:Syntese af uorganiske heteroalkenerStrukturer af gallaphosphen (1) og komplekset af CO 2 (2) og acetophenon (3). (c) UDE/S.Schulz Gruppe 13/15 heteroalkener RMER med M-E dobbeltbindinger (M =B-Tl; E =N-Bi) tilbyder lovende potent
Fremtidige muligheder for lagring af kuldioxid:Syntese af uorganiske heteroalkenerStrukturer af gallaphosphen (1) og komplekset af CO 2 (2) og acetophenon (3). (c) UDE/S.Schulz Gruppe 13/15 heteroalkener RMER med M-E dobbeltbindinger (M =B-Tl; E =N-Bi) tilbyder lovende potent
- Hvordan ville du definere ren kultur steril og forurening i isoleringen af bakterier?
- Vil du med på nanoteknologi? Drag fordel af samarbejdsmiljøer
- Hvad er den bedste definition til bevaring?
- Sjældne arkæologiske fund viser, at klosteret var et socialt og religiøst centrum
- Hvad er er koblingsbiologi?
- Nanozym-aktiverede nanodecoys:En ny strategi til bekæmpelse af urinvejsinfektioner


