Har H2O og H2O2 de samme egenskaber?
Her er en tabel, der opsummerer de vigtigste forskelle:
| Ejendom | H₂O (vand) | H₂O₂ (Hydrogenperoxid) |
| --- | --- | --- |
| struktur | To hydrogenatomer bundet til et iltatom | To hydrogenatomer bundet til to iltatomer |
| Stat ved stuetemperatur | Væske | Væske |
| kogepunkt | 100 ° C (212 ° F) | 150,2 ° C (302,4 ° F) |
| densitet | 1 g/ml | 1,45 g/ml |
| Flammbarhed | Ikke-brandfarlig | Brandbar |
| reaktivitet | Relativt ureaktiv | Stærk oxidation, meget reaktiv |
| toksicitet | Ikke-giftig | Giftig, kan forårsage hudirritation og forbrændinger |
| bruger | Drikke, rengøring, industrielle processer | Desinfektionsmiddel, blegemiddel, raketbrændstof |
Kortfattet:
* h₂o er en stabil, væsentlig forbindelse for livet, mens h₂o₂ er et reaktivt og potentielt farligt kemikalie.
* Mens de begge indeholder brint og ilt, fører det forskellige arrangement af disse atomer til markant forskellige egenskaber.
 Varme artikler
Varme artikler
-
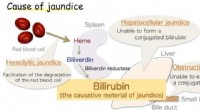 Forskere får gennembrud i antioxidantenzym forbundet med gulsotFig.1:Årsag til gulsot. Bilirubin er det forårsagende materiale til gulsot. Kredit:Osaka University Et japansk forskerhold involveret Osaka University undersøgte biliverdin reduktase, enzymet, der
Forskere får gennembrud i antioxidantenzym forbundet med gulsotFig.1:Årsag til gulsot. Bilirubin er det forårsagende materiale til gulsot. Kredit:Osaka University Et japansk forskerhold involveret Osaka University undersøgte biliverdin reduktase, enzymet, der -
 Sort silicium forhindrer øjenimplantat i at stivneKunstnerens skildring af et okulært implantat. Kredit:Lee, Jeong Oen, Vinayak Narasimhan, Juan Du, David W. Sretavan, og Hyuck Choo:Sort silicium som en biokompatibel antirefleksbelægning til medicins
Sort silicium forhindrer øjenimplantat i at stivneKunstnerens skildring af et okulært implantat. Kredit:Lee, Jeong Oen, Vinayak Narasimhan, Juan Du, David W. Sretavan, og Hyuck Choo:Sort silicium som en biokompatibel antirefleksbelægning til medicins -
 Søger de mest effektive polymerer til personligt beskyttelsesudstyrBrug fluorescens til at demonstrere, hvordan partikler binder forskelligt til forskellige materialetyper. Kredit:Morgan Alexander Personligt beskyttelsesudstyr, som ansigtsmasker og kjoler, er gen
Søger de mest effektive polymerer til personligt beskyttelsesudstyrBrug fluorescens til at demonstrere, hvordan partikler binder forskelligt til forskellige materialetyper. Kredit:Morgan Alexander Personligt beskyttelsesudstyr, som ansigtsmasker og kjoler, er gen -
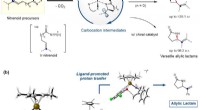 Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er
Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er
- Hvor mange officielle konstellationer findes?
- Ukendte hjælpere af jorden:Hvordan hvirvelløse dyr understøtter nedbrydningsplanter
- Ny metode kan reducere landbrugets drivhusgasudledning betydeligt
- Robust tilgang til fremstilling af polymerbelagte kvanteprikker
- Giv fire egenskaber, der er påvirket af gener og miljø?
- Hvad er modersyren til aluminiumbromid?


