Bestem det tryk, der udøves med 1,80 mol gas i en 2,92 beholder ved 32,0 ° C?
1. Konverter temperatur til Kelvin
* Den ideelle gaslov kræver temperatur i Kelvin.
* K =° C + 273.15
* K =32,0 ° C + 273,15 =305,15 K
2. Ideel gaslov
* Den ideelle gaslov er:PV =NRT
* P =pres (i atmosfærer, ATM)
* V =volumen (i liter, l)
* n =antal mol
* R =ideel gaskonstant (0,0821 l⋅atm/mol⋅k)
* T =temperatur (i Kelvin, K)
3. Løs for tryk (p)
* Omarranger den ideelle gaslov, der skal løses for P:
* P =(nrt) / v
4. Tilslut værdierne
* P =(1,80 mol * 0,0821 l⋅atm / mol⋅k * 305,15 K) / 2,92 L
5. Beregn trykket
* P ≈ 15.3 ATM
Derfor er det tryk, der udøves af gassen, cirka 15,3 atmosfærer.
 Varme artikler
Varme artikler
-
 Forskere identificerer et molekyle, der kunne have hjulpet celler med at overleve - og trives - på …Protoceller ville have været forfædre til celler i dag, hvis du vil, ” siger Ramanarayanan Krishnamurthy, PhD, en lektor i kemi ved Scripps Research. De havde ikke den fulde funktionalitet af moderne
Forskere identificerer et molekyle, der kunne have hjulpet celler med at overleve - og trives - på …Protoceller ville have været forfædre til celler i dag, hvis du vil, ” siger Ramanarayanan Krishnamurthy, PhD, en lektor i kemi ved Scripps Research. De havde ikke den fulde funktionalitet af moderne -
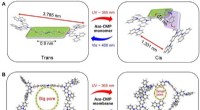 Mikroporøse polymermembraner til let-gatet iontransportSkematisk repræsentation af bottom-up designstrategien for konstruktion af kunstig lys-gatet ionkanalmembran. (A) Trans-cis-trans reversibel isomerisering af den syntetiserede azo-CMP-monomer og (B) d
Mikroporøse polymermembraner til let-gatet iontransportSkematisk repræsentation af bottom-up designstrategien for konstruktion af kunstig lys-gatet ionkanalmembran. (A) Trans-cis-trans reversibel isomerisering af den syntetiserede azo-CMP-monomer og (B) d -
 Forskere opdager proces til bæredygtig fremstilling af psilocybin, en lægemiddelkandidat, der kunn…Junior Alexandra (Lexie) Adams er hovedforfatter i en publiceret artikel af deres resultater i et videnskabeligt tidsskrift. Kredit:Miami University Andrew Jones ved Miami University og hans hold
Forskere opdager proces til bæredygtig fremstilling af psilocybin, en lægemiddelkandidat, der kunn…Junior Alexandra (Lexie) Adams er hovedforfatter i en publiceret artikel af deres resultater i et videnskabeligt tidsskrift. Kredit:Miami University Andrew Jones ved Miami University og hans hold -
 En skjult elektronisk overgang S0 til Tn i tung-atomholdige molekyler(a) Absorptions- og emissionsegenskaber af hypervalent jodforbindelse II; den lodrette akse er normaliseret. (b) Absorptionsspektre af II under forskellige betingelser. Kredit:Masaya Nakajima Fors
En skjult elektronisk overgang S0 til Tn i tung-atomholdige molekyler(a) Absorptions- og emissionsegenskaber af hypervalent jodforbindelse II; den lodrette akse er normaliseret. (b) Absorptionsspektre af II under forskellige betingelser. Kredit:Masaya Nakajima Fors
- Hvor kan du se masser af stjerner på himlen om natten?
- To gange brændt:Winklevii overskygget af Zuckerberg endnu engang
- Producerer fire topkvarker på én gang for at udforske det ukendte
- Robotter vs. mennesker:Hvilken stoler børn mest på, når de lærer ny information?
- Ny bærbar sensor sporer nøjagtigt små ændringer i åndedrætsprocessen
- Nedværdigende jobsamtaler og mobning af chefer er stadig alt for almindelige


