Hvorfor har atomer med en svag elektronegativitet som lithium attraktiv kraft for elektroner?
Her er sammenbruddet:
* Elektronegativitet: Dette er et mål for et atoms evne til at tiltrække elektroner mod sig selv, når det er en del af en kemisk binding. A høj Elektronegativitet betyder en stærk attraktion for elektroner, mens lav Elektronegativitet betyder en svagere attraktion.
* lithium (Li): Lithium har en meget lav elektronegativitet, hvilket betyder, at den ikke tiltrækker elektroner meget stærkt.
* hvorfor mister lithium elektroner? Lithium mister på trods af sin svage elektronegativitet * let * dets yderste elektron for at blive en positivt ladet ion (li⁺). Dette sker, fordi:
* Dets enkelt ydre elektron er langt fra kernen: Dette gør det lettere at fjerne.
* Det ønsker at opnå en stabil elektronkonfiguration: Ved at miste sin ydre elektron opnår lithium den samme elektronkonfiguration som den ædle gashelium, som er ekstremt stabil.
Kortfattet: Mens lithium har en svag elektronegativitet, er det mere sandsynligt, at mister Elektroner end at få dem. Dette tab af elektroner skyldes dets ønske om at nå en stabil elektronkonfiguration, ikke fordi det har en stærk attraktion for elektroner.
 Varme artikler
Varme artikler
-
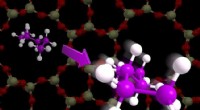 Forskere opdager, hvordan burmolekyler rasler og syngerHexan, et molekyle med seks carbonatomer, vil vælte, spin og vibrere mindre i et nanoporøst bur, men den kan stadig bevæge sig i to dimensioner. Kredit:Catalysis Center for Energy Innovation Et te
Forskere opdager, hvordan burmolekyler rasler og syngerHexan, et molekyle med seks carbonatomer, vil vælte, spin og vibrere mindre i et nanoporøst bur, men den kan stadig bevæge sig i to dimensioner. Kredit:Catalysis Center for Energy Innovation Et te -
 Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org
Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org -
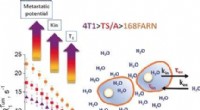 Field-cycling relaxometry kan vurdere tumorstatus ved at måle hastigheden af cellulær vandudveks…Hvor aggressiv er en tumor? For at måle tumorstatus uden at tage vævsprøver, Italienske forskere har udviklet en metode baseret på magnetisk resonansbilleddannelse (MRI) af hele kropsdele. Teknikken m
Field-cycling relaxometry kan vurdere tumorstatus ved at måle hastigheden af cellulær vandudveks…Hvor aggressiv er en tumor? For at måle tumorstatus uden at tage vævsprøver, Italienske forskere har udviklet en metode baseret på magnetisk resonansbilleddannelse (MRI) af hele kropsdele. Teknikken m -
 Forskere udvikler katalysatorer til at omdanne ethanol til kemikalier og brændstoffer af høj værd…Forskere ved Pacific Northwest National Laboratory har udviklet en ny katalysator, der omdanner ethanol til C5+ ketoner, der kan tjene som byggesten til alt fra opløsningsmidler til jetbrændstof. I et
Forskere udvikler katalysatorer til at omdanne ethanol til kemikalier og brændstoffer af høj værd…Forskere ved Pacific Northwest National Laboratory har udviklet en ny katalysator, der omdanner ethanol til C5+ ketoner, der kan tjene som byggesten til alt fra opløsningsmidler til jetbrændstof. I et
- For at advare eller gemme sig for rovdyr? Ny computersimulering giver svar
- Hvad den nye Jurassic Park-film tager galt:Aerodynamisk analyse forårsager en genovervejelse af den…
- Hvilke faste stoffer findes i atmosfæren?
- Glødeforskning:Mindre grene pakker hurtigst, største brandspredende slag
- Sådan fungerer elnet
- Hvordan ioniserer du organ- og kviksølvgas i rørlys?


