Hvad er et salt, hvad den kemiske karakter af salt?
hvad er et salt?
Salt, i kemi, er en ionisk forbindelse dannet af reaktion af en syre og en base . Denne reaktion, kaldet neutralisering , resulterer i dannelsen af et salt og vand .
Her er en sammenbrud:
* syre: Et stof, der donerer hydrogenioner (H+) i opløsning.
* base: Et stof, der accepterer hydrogenioner (H+) i opløsning.
* neutralisering: Reaktionen af en syre og en base, hvor H+ fra syren kombineres med OH-fra basen til dannelse af vand (H2O).
* salt: Den resterende ioniske forbindelse dannet af den positive ion fra basen og den negative ion fra syren.
Eksempel:
* syre: Saltsyre (HCL)
* base: Natriumhydroxid (NaOH)
* neutraliseringsreaktion: HCL + NaOH → NaCl + H2O
* salt: Natriumchlorid (NaCl), almindeligvis kendt som bordsalt.
Kemisk karakter af salt
* ionisk forbindelse: Salt er sammensat af positivt ladede ioner (kationer) og negativt ladede ioner (anioner) afholdt af elektrostatiske kræfter .
* krystalstruktur: Ionerne i salte er arrangeret i en stærkt ordnet krystalgitter hvilket giver dem en bestemt geometrisk form.
* opløselighed: Saltene kan være opløselige eller uopløselige i vand, afhængigt af styrken af de ioniske bindinger og interaktioner med vandmolekyler.
* elektrolyt: Når de er opløst i vand, adskiller salter sig i deres ioner, hvilket gør opløsningen elektrisk ledende .
Almindelige eksempler på salte:
* Natriumchlorid (NaCl) - bordsalt
* Kaliumchlorid (KCL) - Brugt som saltstatning
* Calciumchlorid (CACL2) - Brugt til afisning af veje
* Natriumbicarbonat (NAHCO3) - Bagepulver
* Ammoniumnitrat (NH4NO3) - Brugt som gødning
Kortfattet:
Salt er en ionisk forbindelse dannet af reaktionen af en syre og en base. Det har en karakteristisk krystalstruktur og er ofte opløselig i vand og bliver en elektrolyt. Salte har mange vigtige anvendelser i forskellige brancher og er afgørende for selve livet.
 Varme artikler
Varme artikler
-
 Ioniske edderkoppespind, der imiterer dobbelte funktioner i ægte edderkoppespindKredit:Unsplash/CC0 Public Domain Et team af forskere fra Seoul National University og Eumam Middle School har udviklet en type ionisk edderkoppespind, der er i stand til at efterligne dobbelte fu
Ioniske edderkoppespind, der imiterer dobbelte funktioner i ægte edderkoppespindKredit:Unsplash/CC0 Public Domain Et team af forskere fra Seoul National University og Eumam Middle School har udviklet en type ionisk edderkoppespind, der er i stand til at efterligne dobbelte fu -
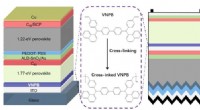 Tværbundne hultransportlag til højeffektive perovskit tandem solcellerSkematisk af perovskit/perovskite og perovskit/silicium tandem solceller. Kredit:© Science China Press Strømkonverteringseffektiviteten (PCE) for perovskite solceller med enkelt kryds (PSCer) er s
Tværbundne hultransportlag til højeffektive perovskit tandem solcellerSkematisk af perovskit/perovskite og perovskit/silicium tandem solceller. Kredit:© Science China Press Strømkonverteringseffektiviteten (PCE) for perovskite solceller med enkelt kryds (PSCer) er s -
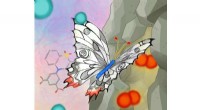 Materialer, der åbner i øjeblikkets varmeSommerfuglformede ligander var nøglen til at designe et materiale, der selektivt kan absorbere og lagre forskellige gasmolekyler. Kredit:Izumi Mindy Takamiya Kyoto-universitetets forskere har desi
Materialer, der åbner i øjeblikkets varmeSommerfuglformede ligander var nøglen til at designe et materiale, der selektivt kan absorbere og lagre forskellige gasmolekyler. Kredit:Izumi Mindy Takamiya Kyoto-universitetets forskere har desi -
 Design af hierarkiske nanoporøse membraner til højeffektive adsorptions- og opbevaringsapplikation…Fotografier af de hierarkiske nanoporøse membraner, der er skabt ved hjælp af en coatingbladsmetode. EN, Fotografi af stort område HNM (10 × 10 cm2) fremstillet ved en rakel-metode. B, Fotografi af fr
Design af hierarkiske nanoporøse membraner til højeffektive adsorptions- og opbevaringsapplikation…Fotografier af de hierarkiske nanoporøse membraner, der er skabt ved hjælp af en coatingbladsmetode. EN, Fotografi af stort område HNM (10 × 10 cm2) fremstillet ved en rakel-metode. B, Fotografi af fr
- Radiometrisk datering: Definition, hvordan fungerer det, anvendelser og eksempler
- Hvad skete der med antallet af valanceelektroner bevæger sig fra venstre højre ved periodisk tabel…
- Forskning viser, hvordan encellede alger roterer, når de svømmer mod lyset
- Hvordan forudsiger folk vejr i gamle tider?
- Hvad er fem almindelige stoffer, der betragtes som organiske kemikalier?
- Hvad konverterer elektrisk energi til kemisk energi?


