Hvad er formlen for polyatomisk ion SO5?
Her er hvorfor:
* svovl (r) Former typisk ioner med afgifter på +2, +4 eller +6.
* ilt (O) Former typisk ioner med et afgift på -2.
For at afbalancere ladningerne i en polyatomisk ion, skal summen af de positive afgifter svare til summen af de negative ladninger. Det er umuligt at opnå dette med SO5, da den samlede negative ladning fra 5 iltatomer (-10) skulle være afbalanceret af en svovlion med en +10 ladning, hvilket ikke er en typisk svovlion.
Almindelige polyatomiske ioner af svovl og ilt:
* sulfit (SO3^2-)
* sulfat (SO4^2-)
* thiosulfat (S2O3^2-)
Sidste artikelHvilke kategorier for faste stoffer?
Næste artikelHvilket metal er en forbindelse?
 Varme artikler
Varme artikler
-
 Brug af radikaliserede NOₓ-derivater understøttet på metaloxiderGrafisk billede af forskningen. Kredit:Korea Institute of Science and Technology (KIST) INGEN x (X=1 eller 2), der udsendes fra papirvarer/mobilkilder, anses traditionelt for at være berygtede,
Brug af radikaliserede NOₓ-derivater understøttet på metaloxiderGrafisk billede af forskningen. Kredit:Korea Institute of Science and Technology (KIST) INGEN x (X=1 eller 2), der udsendes fra papirvarer/mobilkilder, anses traditionelt for at være berygtede, -
 Cellekemi oplyst af laserlysRaman mikrospektroskopi hjælper forskere med at observere cellekemi ved at fokusere en laserstråle på et sted i en celle og derefter fange lys udsendt efter interaktioner med cellulære molekyler, som
Cellekemi oplyst af laserlysRaman mikrospektroskopi hjælper forskere med at observere cellekemi ved at fokusere en laserstråle på et sted i en celle og derefter fange lys udsendt efter interaktioner med cellulære molekyler, som -
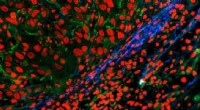 Oplyser vævsdannelse gennem flourescensBillede af tumorgrænse taget ved hjælp af fluorescensmikroskopi. Det nye markørmolekyle viser grænsen for tumoren i blåt; tumorvævet kan ses over det til venstre. Grøn:kollagen, rød:cellekerner. Kredi
Oplyser vævsdannelse gennem flourescensBillede af tumorgrænse taget ved hjælp af fluorescensmikroskopi. Det nye markørmolekyle viser grænsen for tumoren i blåt; tumorvævet kan ses over det til venstre. Grøn:kollagen, rød:cellekerner. Kredi -
 Dioxan-chomping mikrobe har et nyttigt genPedro Alvarez. Kredit:Jeff Fitlow/Rice University Rice University-forskere har opdaget et bakteriebåret gen, der hjælper med at nedbryde en form for dioxan, et grundvandsforurenende stof og formod
Dioxan-chomping mikrobe har et nyttigt genPedro Alvarez. Kredit:Jeff Fitlow/Rice University Rice University-forskere har opdaget et bakteriebåret gen, der hjælper med at nedbryde en form for dioxan, et grundvandsforurenende stof og formod
- Den største solide raketmotor nogensinde klar til den første varme affyring
- Hvordan finder vi ting i rummets mørke?
- Fem måder, hvorpå kunsten kunne hjælpe med at løse plastikkrisen
- Billede:Solen - to bølgelængder, to forskellige billeder
- Hvad er de 2 hovedtyper af menneskeskabte satellitter?
- Biodiverse skove er bedre til at lagre kulstof i lange perioder, siger undersøgelse


