Hvordan adskiller de ydre elektroner i metalatomer sig fra ikke -metale atomer?
metalatomer:
* løst bundet: De ydre elektroner, kendt som valenselektroner, er løst bundet til kernen. Dette betyder, at de let kan løsne og bevæge sig frit gennem metalstrukturen.
* Hav af elektroner: Disse frit bevægende elektroner skaber et "hav af elektroner", der omgiver de positivt ladede metalioner. Dette "hav" er ansvarlig for mange af de unikke egenskaber ved metaller, såsom konduktivitet og formbarhed.
* delokaliseret: Valenselektronerne er ikke forbundet med et specifikt atom, men deles gennem hele metalgitteret.
* let mistet: Metalatomer har en tendens til at miste deres valenselektroner og danne positive ioner (kationer).
ikke -metale atomer:
* tæt bundet: Ikke -metale atomer har deres valenselektroner tæt bundet til kernen. De er ikke let løsrevet eller deles.
* lokaliseret: Disse elektroner er specifikt forbundet med deres respektive atomer, ikke delt med andre.
* Få elektroner: Ikke -metaller har en tendens til at få elektroner for at opnå en stabil elektronkonfiguration og danne negative ioner (ANION).
Sådan påvirker disse forskelle egenskaberne for metaller og ikke -metaller:
* Konduktivitet: De frit bevægende elektroner i metaller giver dem mulighed for at udføre elektricitet og varme let. Ikke -metaller med deres tæt bundne elektroner er dårlige ledere.
* formbarhed og duktilitet: Elektronernes hav i metaller giver metalioner mulighed for at glide forbi hinanden uden at bryde strukturen, hvilket fører til formbarhed (evne til at blive hamret i ark) og duktilitet (evne til at blive trukket ind i ledninger). Ikke -metaller er generelt sprøde og bryder let.
* Luster: De frie elektroner i metaller afspejler lys, hvilket giver dem et skinnende udseende (metallisk glans). Ikke -metaller mangler denne egenskab.
* Kemisk binding: Metaller har en tendens til at danne ioniske bindinger ved at miste elektroner til ikke -metaller. Ikke -metaller danner kovalente bindinger ved at dele elektroner med andre ikke -metaller.
Kortfattet: Den vigtigste forskel ligger i mobilitet og bindingsstyrke af valenselektronerne. Metalatomer har løst bundet, delokaliserede elektroner, mens ikke -metale atomer har tæt bundet, lokaliserede elektroner. Denne grundlæggende forskel fører til meget forskellige fysiske og kemiske egenskaber.
Sidste artikelHvad er et opløsningsmiddellim?
Næste artikelEr luft en soild væske eller gas?
 Varme artikler
Varme artikler
-
 Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul
Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul -
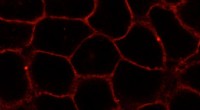 Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B
Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B -
 Forbedret osteogen aktivitet af præ-osteoblaster på overflademodificerede 3-D printede stilladserTekniske materialeoverflader for maksimal cellelevedygtighed. Billedkredit:https://www.regenhu.com/3d-bio-printers Kredit:Biomedicinske materialer, doi:10.1088/1748-605x/aaeb82 Materialer såsom po
Forbedret osteogen aktivitet af præ-osteoblaster på overflademodificerede 3-D printede stilladserTekniske materialeoverflader for maksimal cellelevedygtighed. Billedkredit:https://www.regenhu.com/3d-bio-printers Kredit:Biomedicinske materialer, doi:10.1088/1748-605x/aaeb82 Materialer såsom po -
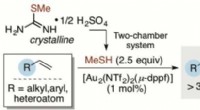 Forskere rapporterer om en enklere metode til sikker håndtering af methanthiol i kemisk synteseNy metode af professor Troels Skrydstrup ved Aarhus Universitet til hydrothiolering af π-systemer med overgangsmetalkomplekser. Kredit:Troels Skrydstrup Det kemiske grundstof svovl er en vigtig be
Forskere rapporterer om en enklere metode til sikker håndtering af methanthiol i kemisk synteseNy metode af professor Troels Skrydstrup ved Aarhus Universitet til hydrothiolering af π-systemer med overgangsmetalkomplekser. Kredit:Troels Skrydstrup Det kemiske grundstof svovl er en vigtig be
- Hvordan kan reaktionen med oxygen bruges til at skelne et metal fra et ikke-metal?
- Er silikone et element eller forbindelse?
- Hvilken vigtig udvikling fandt sted i videnskabelige instrumenter?
- Hvem opfandt det mørke feltmikroskop?
- NASA demonstrerer ny teknologi til at se stjerne med tusindvis af skodder
- Se musikken i øjnene:Eksplicitte advarsler mod piratkopiering er bedst afskrækkende


