Opløses oxalsyre i svovlsyre?
* Oxalsyre er en svag syre: Det ioniseres ikke i vand, hvilket betyder, at det ikke frigiver alle sine hydrogenioner (H+).
* svovlsyre er en stærk syre: Det ioniseres i vand og frigiver en betydelig mængde H+ -ioner.
* ligevægtsskift: Når oxalsyre tilsættes til svovlsyre, skifter det stærke syremiljø ligevægt af oxalinsyreioniseringen mod den uudskillede form. Dette "undertrykker" ioniseringen af oxalsyre ionisering af oxalinsyre.
reaktionen:
Reaktionen mellem oxalsyre (H2C2O4) og svovlsyre (H2SO4) resulterer i dannelsen af oxoniumioner (H3O+) og bisulfationer (HSO4-) sammen med uudskilt oxalsyre.
H2C2O4 (aq) + H2SO4 (aq) ⇌ H3O + (aq) + HSO4- (aq) + H2C2O4 (aq)
Nøglepunkter:
* Reaktionen er reversibel , hvilket betyder, at oxalsyren kan reformere under visse betingelser.
* Tilstedeværelsen af svovlsyre mindsker ioniseringen af oxalsyre.
* Opløsningen vil være meget sur på grund af tilstedeværelsen af H3O+ -ioner.
Ansøgninger:
Denne reaktion anvendes i forskellige applikationer, herunder:
* Analytisk kemi: At bestemme koncentrationen af oxalsyre i en opløsning.
* organisk syntese: Som reagens til fremstilling af forskellige organiske forbindelser.
* rengøring: Oxalsyre, i kombination med svovlsyre, bruges til at fjerne rust og andre metaloxider.
sikkerhed:
Både svovlsyre og oxalsyre er ætsende. Det er vigtigt at håndtere dem med omhu og bære passende sikkerhedsudstyr. Reaktionen kan generere varme, så det er vigtigt at udføre den i et godt ventileret område.
Sidste artikelHvor får elektroner deres i fotosystem I?
Næste artikelHvordan opløser du jernkjlorid?
 Varme artikler
Varme artikler
-
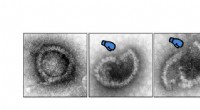 Et skridt på vejen mod bedre behandlinger mod viraEt elektronmikroskopbillede. Det viser, hvordan herpesvirus angribes af proteinet MxB. Kredit:Manutea Serrero &Beate Sodeik, Virology, Hannover Medical School, Tyskland. De fleste celler kan forsva
Et skridt på vejen mod bedre behandlinger mod viraEt elektronmikroskopbillede. Det viser, hvordan herpesvirus angribes af proteinet MxB. Kredit:Manutea Serrero &Beate Sodeik, Virology, Hannover Medical School, Tyskland. De fleste celler kan forsva -
 Forskere dyrker hurtigt en langfrøet DKDP-krystalStor langfrøet DKDP-krystal med et langt frø. Kredit:SIOM DKDP (KD x H 2-x PO 4 ), som kan minimere stimuleret Raman -spredning, er den bedste ikke -lineære krystal, der bruges som en triple
Forskere dyrker hurtigt en langfrøet DKDP-krystalStor langfrøet DKDP-krystal med et langt frø. Kredit:SIOM DKDP (KD x H 2-x PO 4 ), som kan minimere stimuleret Raman -spredning, er den bedste ikke -lineære krystal, der bruges som en triple -
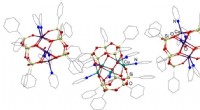 Kemikere syntetiserer en ny katalysator til olie- og gasbehandlingStrukturen af pentanukleære prismatiske metallasilsesquioxaner (kobber og koboltholdig) Kredit:Alexey Bilyachenko Et team af forskere fra Research Institute of Chemistry (RIC) ved RUDN Universit
Kemikere syntetiserer en ny katalysator til olie- og gasbehandlingStrukturen af pentanukleære prismatiske metallasilsesquioxaner (kobber og koboltholdig) Kredit:Alexey Bilyachenko Et team af forskere fra Research Institute of Chemistry (RIC) ved RUDN Universit -
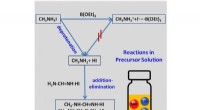 Aldring af perovskite-løsning:Forskere finder en løsningDen rene stabilisator triethylborat bruges til at hæmme sidereaktioner i perovskit-opløsningen. Kredit:WANG Xiao Et forskerhold fra Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT
Aldring af perovskite-løsning:Forskere finder en løsningDen rene stabilisator triethylborat bruges til at hæmme sidereaktioner i perovskit-opløsningen. Kredit:WANG Xiao Et forskerhold fra Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT
- Hvad er der i skyen af negativt ladede partikler, der omgiver et atomer?
- Hvad er farven på solen?
- Er en ophæng et andet navn for heterogen blanding?
- Forskere forklarer, hvorfor nogle molekyler spontant arrangerer sig selv i fem skiver af nanoskala t…
- Ny manifestation af magnetiske monopoler opdaget
- Ny opdagelse hjælper myndighederne med at identificere heroinets oprindelse


