Når alle grupper IIA mister deres valenselektroner, er de resterende konfigurationer de samme som for hvilken familie af elementer?
Her er hvorfor:
* gruppe IIA -elementer har to elektroner i deres yderste skal (S-orbital).
* gruppe VIIIA elementer Har en fuld ydre skal, hvilket gør dem meget stabile.
* Når gruppe IIa -elementer mister deres to valenselektroner, opnår de den samme elektronkonfiguration som den ædle gas i den foregående periode.
for eksempel:
* magnesium (mg) (Gruppe IIA) mister sine to valenselektroner for at blive MG²⁺. Dens resterende elektronkonfiguration er [NE] 2S²2p⁶, som er den samme som neon (NE) (Gruppe VIIIA).
* calcium (CA) (Gruppe IIA) mister sine to valenselektroner for at blive Ca²⁺. Dens resterende elektronkonfiguration er [AR] 3S²3p⁶, som er den samme som argon (AR) (Gruppe VIIIA).
Dette er grunden til, at alkaliske jordmetaller let danner +2 kationer og er meget reaktive og stræber efter at opnå den stabile elektronkonfiguration af de ædle gasser.
Sidste artikelHvad er den mest almindelige type flydende mineraler?
Næste artikelHvad er hårdheden ved Beryllium?
 Varme artikler
Varme artikler
-
 Et biomasse-til-væske-anlæg til fremstilling af bæredygtigt syntetisk brændstofKredit:Gunther Kolb Et EU-projekt udviklede innovative nanokatalysatorer for at skabe en integreret modulær og højeffektiv proces til fremstilling af brændstoffer fra vedvarende energikilder. Kli
Et biomasse-til-væske-anlæg til fremstilling af bæredygtigt syntetisk brændstofKredit:Gunther Kolb Et EU-projekt udviklede innovative nanokatalysatorer for at skabe en integreret modulær og højeffektiv proces til fremstilling af brændstoffer fra vedvarende energikilder. Kli -
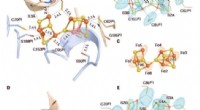 Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A
Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A -
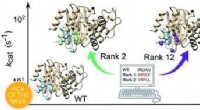 Gamle enzymer kan bidrage til grønnere kemiKredit: Kemisk Videnskab (2020). DOI:10.1039/D0SC01935F Et forskerhold ved Uppsala Universitet har genoplivet flere milliarder år gamle enzymer og omprogrammeret dem til at katalysere helt andre
Gamle enzymer kan bidrage til grønnere kemiKredit: Kemisk Videnskab (2020). DOI:10.1039/D0SC01935F Et forskerhold ved Uppsala Universitet har genoplivet flere milliarder år gamle enzymer og omprogrammeret dem til at katalysere helt andre -
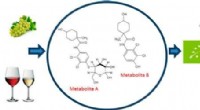 Kontrol af økologiske fødevarerKredit:American Chemical Society Økologiske fødevarer bliver stadig mere populære - og dyre. Økologisk frugt og grønt dyrkes uden syntetiske pesticider, og på grund af det, de opfattes ofte som me
Kontrol af økologiske fødevarerKredit:American Chemical Society Økologiske fødevarer bliver stadig mere populære - og dyre. Økologisk frugt og grønt dyrkes uden syntetiske pesticider, og på grund af det, de opfattes ofte som me
- Emissionsnabler som M42 forekommer kun i nærheden af stjerner, der udsender store mængder af?
- Øget kørestolsindsats viser en beundringsværdig respekt for uafhængighed
- Solar Power vs Coal
- Hvilken stjerne er større neutron- eller subgant stjerne?
- Hjælper retrospektive justeringer af bæredygtighedsrapporter administrerende direktører med at op…
- Høst i det gamle Egypten


