Hvorfor er de kemiske egenskaber ved Argon Krypton og Xenon ens, selvom der er 18 elementer mellem 32 Xenon?
Her er grunden til, at deres egenskaber er ens på trods af det store hul i deres atomnumre:
* Elektronkonfiguration: Det definerende kendetegn ved ædle gasser er deres fuldstændigt fyldte yderste elektronskal , hvilket gør dem meget stabile og ureaktive.
* Argon har elektronkonfigurationen [NE] 3S²3p⁶
* Krypton har elektronkonfigurationen [AR] 3D¹⁰4S²4P⁶
* Xenon har elektronkonfigurationen [KR] 4D¹⁰5S²5p⁶
Bemærk, hvordan den yderste skal (valensskallen) er fyldt med 8 elektroner (eller 2 til helium).
* Lignende reaktivitet: På grund af deres fulde valensskaller har ædle gasser en meget lav tendens til at vinde eller miste elektroner. De er derfor meget ureaktive og findes som enkeltatomer og ikke danner molekyler let.
Hvorfor kløften?
Kløften i atomnumre mellem disse elementer skyldes påfyldningen af D-orbitaler (overgangsmetaller) i den periodiske tabel. Når du bevæger dig ned ad den periodiske tabel, bliver D-orbitaler gradvist fyldt med elektroner. Derfor er der 18 elementer mellem Argon og Krypton og 18 mellem Krypton og Xenon.
resume
På trods af det tilsyneladende store spring i atomnumre deler de ædle gasser Argon, Krypton og Xenon lignende kemiske egenskaber på grund af deres stabile, fyldte valenselektronskaller. Denne fælles funktion fører til deres meget lave reaktivitet og gør dem forskellige fra andre elementer.
 Varme artikler
Varme artikler
-
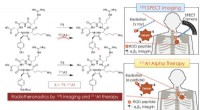 Radioisotoppar til tumordiagnose og terapiKonceptet radiotheranostics ved hjælp af At-211 og I-123 til kræftdiagnose og terapi. Kombination af SPECT-billeddannelse ved hjælp af I-123-mærket RGD-peptid med målrettet alfa-terapi ved hjælp af At
Radioisotoppar til tumordiagnose og terapiKonceptet radiotheranostics ved hjælp af At-211 og I-123 til kræftdiagnose og terapi. Kombination af SPECT-billeddannelse ved hjælp af I-123-mærket RGD-peptid med målrettet alfa-terapi ved hjælp af At -
 Test af de antibakterielle egenskaber af hydrofobe overflader på ISSKredit:European Space Agency Et rør ikke-direktiv gælder både for et Matisse-maleri og dette Matiss-eksperiment om bord på den internationale rumstation. Designet til at teste de antibakterielle
Test af de antibakterielle egenskaber af hydrofobe overflader på ISSKredit:European Space Agency Et rør ikke-direktiv gælder både for et Matisse-maleri og dette Matiss-eksperiment om bord på den internationale rumstation. Designet til at teste de antibakterielle -
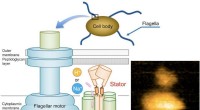 Forskere beskriver mekanismen bag flagellar motilitetFig. 1. Skematisk diagram af den bakterielle flagelmotor og et typisk AFM-billede af oprenset MotPS-kompleks. Kredit:Osaka University Bakterier svømmer på mange forskellige måder, og motorerne, de
Forskere beskriver mekanismen bag flagellar motilitetFig. 1. Skematisk diagram af den bakterielle flagelmotor og et typisk AFM-billede af oprenset MotPS-kompleks. Kredit:Osaka University Bakterier svømmer på mange forskellige måder, og motorerne, de -
 Forskere løser en materialemysternøgle til næste generations elektroniske enhederMaterialevidenskab og teknik postdoktorforsker Hyungwoo Lee kigger inde i et tyndfilmsdepositionssystem under vækst af oxid tyndfilmstruktur. Kredit:Renee Meiller Lennon og McCartney. Abbott og Co
Forskere løser en materialemysternøgle til næste generations elektroniske enhederMaterialevidenskab og teknik postdoktorforsker Hyungwoo Lee kigger inde i et tyndfilmsdepositionssystem under vækst af oxid tyndfilmstruktur. Kredit:Renee Meiller Lennon og McCartney. Abbott og Co
- Kan vi se NASA -flagene og tingene venstre måne?
- Hvor mange lysår er kviksølv fra solen?
- Radiofysikere fordobler solcellernes effektivitet
- Hvor mange yds i 39 ft?
- Balancer tilgivelsesprogrammer mere effektive til at reducere kreditkortgæld end at sænke månedli…
- Forskere udvikler lægemidler til at muliggøre længere rummissioner


