Forskere beskriver mekanismen bag flagellar motilitet
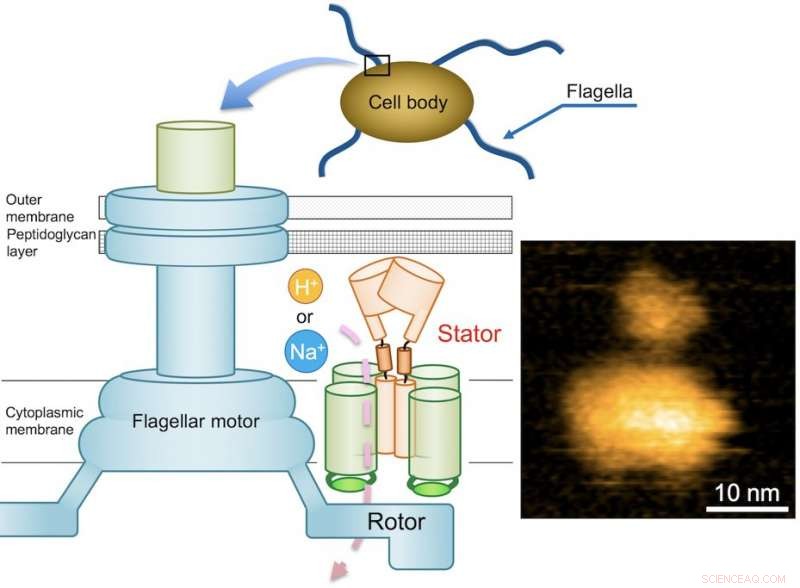
Fig. 1. Skematisk diagram af den bakterielle flagelmotor og et typisk AFM-billede af oprenset MotPS-kompleks. Kredit:Osaka University
Bakterier svømmer på mange forskellige måder, og motorerne, der driver deres svømning, er vidt forskellige, indebærer en adaptiv reaktion på et miljø. En af de mest almindeligt identificerede af sådanne motorer er flageller. Selvom det at give motilitet er et primært træk ved flageller, klæbemiddel og andre egenskaber er også blevet tillagt dem.
Flagelmotoren består af en rotor og et dusin statorenheder, og drives af den energi, der skabes af ioner, når de migrerer over cellemembranen. Mens flagelmotoren af nogle ferskvands- og enteriske bakterier, som Salmonella, drives af protoner (brintioner, H + ), som består af fire kopier af proteinet MotA og to kopier af MotB, motorer af andre bakterier, der lever i saltvandsmiljøer, drives af natriumioner (Na + ).
I tilfælde af Bacillus subtilis (B. subtilis), en bakterie, der almindeligvis findes i jorden, flagelmotoren har to forskellige typer statorenheder:H+-type MotAB og Na+-type MotPS. Mens komponenterne er identificeret, mekanismen, der driver flagelmotoren, er stadig ukendt. Dette mysterium forstærkes yderligere af det faktum, at flageller ikke er tydeligt synlige under lysmikroskopet. Disse udfordringer satte et team af Osaka University-centrerede forskere på en søgen efter at belyse den ukendte mekanisme. De rapporterede deres resultater i Videnskabens fremskridt .
"Nøjagtige analyser af strukturel dynamik af flagelmotoren ved hjælp af højhastigheds atomkraftmikroskopi (HS-AFM) kombineret med mutationsanalyse gav indsigt i flagelmotorens drejningsmomentgenereringsmekanisme, ", siger den første forfatter af undersøgelsen, Naoya Terahara. "Vi lavede realtidsobservationer af de Na+-inducerede strukturelle ændringer i domænet af MotS, der binder peptidoglycan, en polymer bestående af sukkerarter og aminosyrer i bakterier."
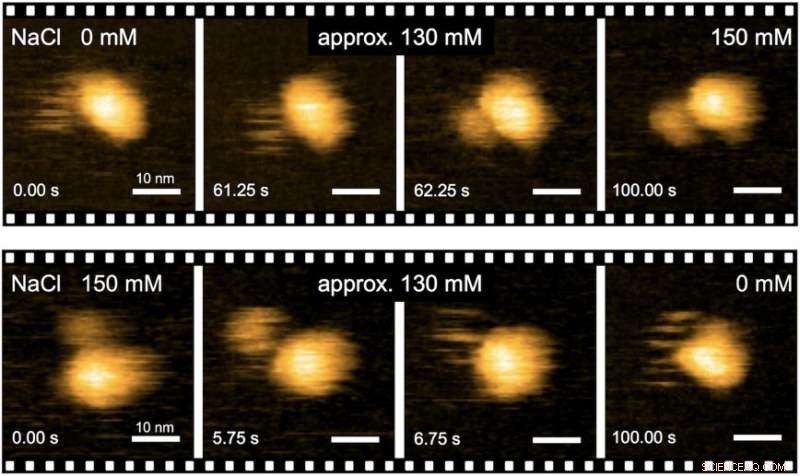
Fig. 2. Real-time billeddannelse af Na+-inducerede strukturelle overgange af MotPS-komplekset ved HS-AFM. Kredit:Osaka University
For at forstå, hvordan MotPS-proteinkomplekset reagerer på ændringer i miljøet, forskerne karakteriserede først forholdet mellem drejningsmoment og hastighed af B. subtilis-motoren over en lang række Na+-koncentrationer. Motorens maksimale hastighed blev reduceret fra ca. 200 til 80 Hz, når den eksterne Na+-koncentration blev øget fra 0 til 200 mM, selvom stall-momentet slet ikke blev ændret.
Især når domænet af MotB, der binder til peptidoglycan, blev erstattet af det af MotS, den kimære motor opretholdt den samme drejningsmoment-hastighedskurve som MotAB-motoren i nærvær af Na+ ioner, men ikke i fravær. Dette betyder, at Na+ er den vigtigste drivkraft for samling og aktivering af flagelmotor, uanset dens sammensætning.
"I fravær af natriumioner, MotPS eksisterer som en inaktiv form i den cytoplasmatiske membran, fordi MotSc, det C-terminale periplasmatiske domæne af MotS, antager en udfoldet konformation. Når koncentrationen af natriumioner øges, bindingen af ionerne til MotSc inducerer foldningen af PGB-domænet og letter dets dimerisering på en meget samarbejdsvillig måde, " siger den tilsvarende forfatter Tohru Minamino.
Gennem denne undersøgelse, holdet har også demonstreret gennemførligheden af at bruge HS-AFM kombineret med mutationsanalyse til at studere indviklede bakteriestrukturer, som kan give værdifuld indsigt til industriel produktion af kommercielt levedygtige produkter, såsom proteaser og terapeutika, som i tilfældet med B. subtilis.
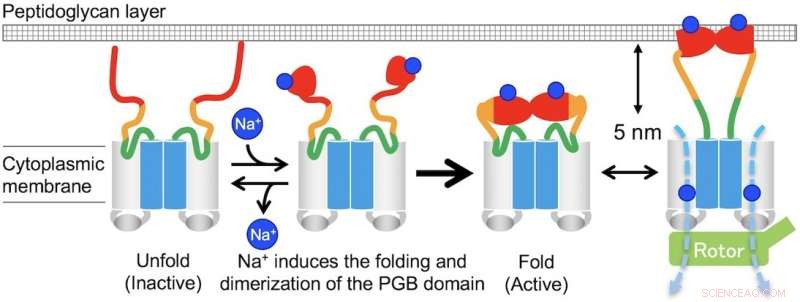
Fig. 3. Model for den Na+-inducerede samling og demontering af MotPS statorkomplekset. Kredit:Osaka University
 Varme artikler
Varme artikler
-
 Identifikation af det mørke stof i den molekylære verdenKredit:CC0 Public Domain Forestil dig, at dit Facebook-feed udgør et fristende puslespil. Du bliver præsenteret for et par fragmenter om en person - øjenfarve, hårfarve, alder, og højde – og har k
Identifikation af det mørke stof i den molekylære verdenKredit:CC0 Public Domain Forestil dig, at dit Facebook-feed udgør et fristende puslespil. Du bliver præsenteret for et par fragmenter om en person - øjenfarve, hårfarve, alder, og højde – og har k -
 Katodefejl forbedrer batteriets ydeevneTilsvarende forfatter Peter Khalifah (til venstre) med sine elever/medforfattere Gerard Mattei (i midten) og Zhuo Li (til højre) på et af Brookhavens kemi-laboratorier. Kredit:Brookhaven National Labo
Katodefejl forbedrer batteriets ydeevneTilsvarende forfatter Peter Khalifah (til venstre) med sine elever/medforfattere Gerard Mattei (i midten) og Zhuo Li (til højre) på et af Brookhavens kemi-laboratorier. Kredit:Brookhaven National Labo -
 Kuldetilpassede enzymer kan transformeres ved stuetemperaturKredit:CC0 Public Domain Enzymer fra kulde-elskende organismer, der lever ved lave temperaturer, tæt på vands frysepunkt, udviser meget karakteristiske egenskaber. I en ny undersøgelse offentliggj
Kuldetilpassede enzymer kan transformeres ved stuetemperaturKredit:CC0 Public Domain Enzymer fra kulde-elskende organismer, der lever ved lave temperaturer, tæt på vands frysepunkt, udviser meget karakteristiske egenskaber. I en ny undersøgelse offentliggj -
 Hvorfor bruges magnesiumklorid i PCR?Når en efterforsker eller en læge får en DNA-prøve, er der ofte ikke nok DNA til rådighed til korrekt analyse. For at simulere kroppens egen DNA-replikationsproces udviklede forskere en proces kald
Hvorfor bruges magnesiumklorid i PCR?Når en efterforsker eller en læge får en DNA-prøve, er der ofte ikke nok DNA til rådighed til korrekt analyse. For at simulere kroppens egen DNA-replikationsproces udviklede forskere en proces kald
- Hvorfor smelter salt is hurtigere end sukker?
- Sådan løses store eksponenter
- Individuelle uddannelser anvendes ikke efter hensigten i specialundervisningen
- Afrikanske rumhavne reducerer omkostningerne til raketbrændstof
- Arkæologer i eksil fra Syrien sørger over omkostningerne ved krigen
- Multitasking-katalysatoren


