Forskere folder et protein i et protein
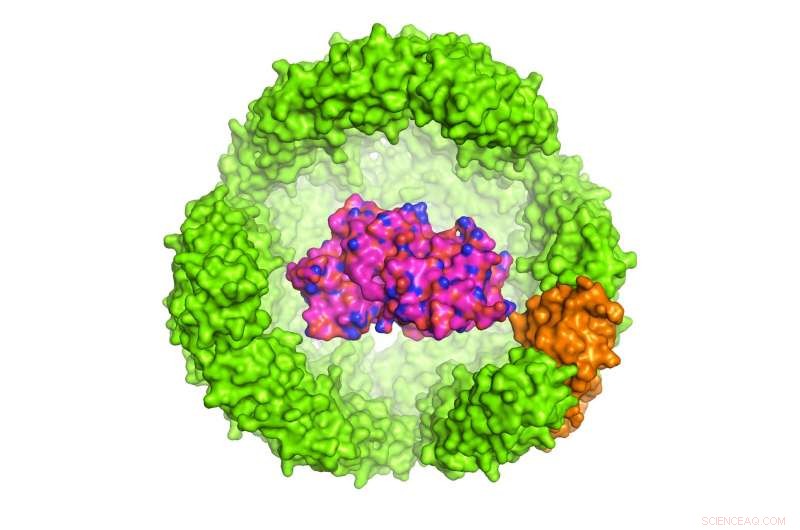
Illustration af et protein af interesse (POI) inde i en 24-underenhed Archeoglobus fulgidus ferritin exoshell, som er 12 nanometer i diameter (kun halvdelen af skallen er vist). Kredit:Dr. Chester L. Drum
Et team fra NUS Yong Loo Lin School of Medicine (NUS Medicine) har opfundet en fundamentalt ny måde at folde og beskytte rekombinante proteiner på. Kommer fra det hastigt voksende felt inden for syntetisk biologi, denne protein-in-a-protein-teknologi kan forbedre det funktionelle proteinudbytte 100 gange og beskytte rekombinante proteiner mod varme, skrappe kemikalier og proteolyse.
Ekspression og stabilisering af rekombinante proteiner er hjørnestenen i den biologiske og farmaceutiske industri. Omkostningerne og kompleksiteten forbundet med fremstilling af svært-foldelige rekombinante proteiner i industriel skala er en væsentlig begrænsende faktor for deres anvendelse i kliniske og industrielle anvendelser.
Undersøgelsen ledet af Dr. Chester Drum, Adjunkt ved Institut for Medicin og Biokemi, NUS Medicin blev offentliggjort i tidsskriftet Naturkommunikation den 13. november 2017. Drum og kolleger konstruerede en exoshell med en diameter på 12 nanometer og viklede den rundt om et protein af interesse (POI). De viste for første gang, at denne teknologi kan bruges til at folde og beskytte en række proteiner i konstruerede hulrum, der er mindre end 1:10, 000 bredden af et menneskehår.
Forskerne udviklede denne protein-inden-et-protein-teknologi ved hjælp af Archeoglobus fulgidus, en hårdfør bakterie, der naturligt findes i hydrotermiske ventilationsåbninger. Disse hypertermofile bakterier har udviklet unikke løsninger til proteinfoldning og stabilisering på grund af de ekstreme miljøer, de lever i.
I særdeleshed, forskerne brugte en jernbærende, 24-underenhedsprotein i A. fulgidus kaldet ferritin, hvis naturlige funktion er at opbevare og transportere jern i blodet. Ferritin fra A. fulgidus har to unikke egenskaber:For det første, fire bittesmå porer i dens skal giver små molekyler adgang til hulrummet; sekund, i modsætning til humant ferritin, som er stabilt ved lave saltkoncentrationer, det konstruerede A. fulgidus ferritin dissocieres ved lave saltkoncentrationer, tillader indholdet af hulrummet at blive frigivet ved en simpel pH-omskifter fra 8,0 til 5,8. Når først er dissocieret, POI'et kan frigives enzymatisk.
For at demonstrere den brede alsidighed af deres teknologi, forskerne testede deres exoshell-teknologi ved at fusionere en af de 24 ferritin-underenheder omkring tre POI'er med forskellige egenskaber - grønt fluorescerende protein, peberrodsperoxidase (HRP) og Renilla luciferase.
Ikke alene hjalp exoshellen med at øge udbyttet af alle tre POI'er, forskerne var også i stand til at levere cofaktorer hæm og calcium, ud over oxiderende forhold, for at sikre, at komplekse POI'er såsom HRP-protein kunne foldes og fungere korrekt.
Udover at hjælpe med at folde POI'erne korrekt, exoskallerne var også beskyttende mod en lang række denatureringsmidler, inklusive højkoncentration trypsin; organiske opløsningsmidler, såsom acetonitril og methanol; og denatureringsmidler såsom urinstof, guanidin saltsyre, og varme.
"Vi antager, at den betydelige stigning i funktionelt proteinudbytte kan skyldes komplementeringen mellem de negativt ladede proteiner og den positivt ladede exoshell indre overflade. Vores resultater fremhæver potentialet ved at bruge højkonstruerede skaller på nanometerstørrelse som et syntetisk biologisk værktøj til dramatisk påvirker produktionen og stabiliteten af rekombinante proteiner, " sagde Drum, som også er konsulterende kardiolog ved National University Hospital og direktør for Clinical Trial Innovation Lab på TLGM, EN STJERNE.
Rekrutteret til National University of Singapore i 2011, han har siden modtaget finansiering fra Singapore MIT Alliance for Research and Technology, National Medical Research Council, Biomedicinsk Forskningsråd, A*STAR og NUS Medicin.
Drums nuværende forskning bygger bro mellem grundlæggende biokemi og klinisk pleje. Han er i øjeblikket den primære efterforsker på en multiinstitutionel, 3, 000-personers observationsforsøg i Singapore, der studerer, hvordan personlig stofmetabolisme påvirker lægemiddelrespons.
Sidste artikelForskere beskriver mekanismen bag flagellar motilitet
Næste artikelBiokatalysatorer er en bro til grønnere, stærkere kemi
 Varme artikler
Varme artikler
-
 Elektrospundne fibre væver nye medicinske innovationerElektrospundet fiber ligner et edderkoppespind. Kredit:Joseph Fuqua II/UC Creative Services Når du besøger Andrew Steckls laboratorium ved University of Cincinnati, du ser en ubeskrivelig glaskass
Elektrospundne fibre væver nye medicinske innovationerElektrospundet fiber ligner et edderkoppespind. Kredit:Joseph Fuqua II/UC Creative Services Når du besøger Andrew Steckls laboratorium ved University of Cincinnati, du ser en ubeskrivelig glaskass -
 Mekanismer for bevaring af blødt væv og protein i Tyrannosaurus rexEt fossilt eksemplar af T. rex (AMNH 5027) udstillet på American Museum of Natural History, i 2019. Kredit:Nationalmuseet for Naturhistorisk, New York City. amnh.org/exhibitions/permanent/saurischian-
Mekanismer for bevaring af blødt væv og protein i Tyrannosaurus rexEt fossilt eksemplar af T. rex (AMNH 5027) udstillet på American Museum of Natural History, i 2019. Kredit:Nationalmuseet for Naturhistorisk, New York City. amnh.org/exhibitions/permanent/saurischian- -
 Hvidvin, citronsaft combo forhindrer uønsket misfarvning af wienerbrødsdejKredit:CC0 Public Domain Lige meget om det er bedstemors småkager eller kommercielt fremstillede rundstykker, wienerbrød elskere forventer, at deres bagværk har en vis gyldenbrun tiltrækning - men
Hvidvin, citronsaft combo forhindrer uønsket misfarvning af wienerbrødsdejKredit:CC0 Public Domain Lige meget om det er bedstemors småkager eller kommercielt fremstillede rundstykker, wienerbrød elskere forventer, at deres bagværk har en vis gyldenbrun tiltrækning - men -
 Forskere udvikler ny røntgendetekteringsteknologiEn forsker har en fleksibel røntgenscintillator udviklet af professor Biwu Ma og hans forskerhold. Teamet har udviklet et nyt materiale, der kan bruges til at lave fleksible røntgendetektorer, der er
Forskere udvikler ny røntgendetekteringsteknologiEn forsker har en fleksibel røntgenscintillator udviklet af professor Biwu Ma og hans forskerhold. Teamet har udviklet et nyt materiale, der kan bruges til at lave fleksible røntgendetektorer, der er
- Steroidbinding til metabolisk enzym
- Fysikeren foreslår en måde at registrere lukkerhastigheder for kameraer, der glimter med molekyler
- Forskere opdager, hvordan forskellige nanomaterialeflader påvirker proteiner
- Hvordan kan visse stoffer holde varmen?
- Fordelene ved rekonvalescent plasma til COVID-19 er stadig uklare
- Hvad er UCL & LCL?


