Forskere opdager, hvordan forskellige nanomaterialeflader påvirker proteiner
En ny undersøgelse ledet af eksperter i nanoteknologi og bioteknologi ved Rensselaer Polytechnic Institute giver vigtige detaljer om, hvordan proteiner i vores kroppe interagerer med nanomaterialer. I deres nye undersøgelse, udgivet i den 2. februar online udgave af tidsskriftet Nano breve, forskerne udviklede et nyt værktøj til at bestemme proteinernes orientering på forskellige nanostrukturer. Opdagelsen er et vigtigt skridt i bestræbelserne på at kontrollere orienteringen, struktur, og funktion af proteiner i kroppen ved hjælp af nanomaterialer.
"Til dato, meget lidt er kendt om, hvordan proteiner interagerer med en overflade på nanoskalaen, "sagde Jonathan Dordick, direktør for Center for Bioteknologi og Tværfaglige Studier på Rensselaer (CBIS), Howard P. Isermann '42 professor i kemisk og biologisk teknik, og medkorresponderende forfatter af undersøgelsen. "Med en bedre forståelse af, hvordan et protein interagerer med en overflade, vi kan udvikle brugerdefinerede nanoskalaoverflader og designe proteiner, der kan udføre en række fantastiske opgaver i menneskekroppen. "
Forskere søger at bruge nanoteknologi i en række biologiske og medicinske anvendelser, lige fra biosensorer, der kan opdage kræft i kroppen til stilladser, der hjælper med at dyrke nyt væv og organer, ifølge forskerne. Sådanne teknologier involverer interaktionen mellem biologiske celler og ikke-biologiske nanoskala materialer. Disse interaktioner styres delvist af proteiner ved grænsefladen mellem de to materialer. På et så lille niveau, den mindste ændring i et materiales struktur kan i høj grad ændre de involverede proteiner og dermed ændre, hvordan cellerne i den menneskelige krop reagerer på nanomaterialet. Faktisk, proteiner er blandt de mest komplekse (og ustabile) molekyler i vores kroppe, hurtigt ændrer deres orientering eller struktur og dermed deres evne til at interagere med andre molekyler. At kontrollere deres orientering og struktur gennem deres interaktioner med nanomaterialer er afgørende for deres pålidelige og sikre anvendelse i nye bioteknologier, ifølge Dordick.
"Vi har lært det sidste årti at skabe nanomaterialer med en lang række kontrollerede strukturer, og vi har opdaget og begyndt at lære, hvordan disse strukturer kan påvirke cellulær aktivitet positivt, "sagde Richard Siegel, Robert W. Hunt -professor i materialevidenskab og teknik ved Rensselaer, direktør for Rensselaer Nanoteknologicenter, og co-tilsvarende forfatter på undersøgelsen. "Ved at lære mere om rollen som nanostruktur-protein-interaktioner, der forårsager denne indvirkning, vi vil i fremtiden kunne udnytte denne viden til gavn for samfundet gennem forbedret sundhedspleje. Udover forbedret sundhedspleje, dette arbejde vil også bidrage til at muliggøre fremstilling af en lang række nye hierarkiske kompositmaterialer - baseret på syntetiske polymerer, biomolekyler, og nanostrukturer - det vil revolutionere vores evne til at løse mange kritiske problemer, som samfundet står over for verden over. "
Hvad forskerne fandt i dette og deres tidligere undersøgelser var, at nanoverfladens størrelse og krumning i høj grad ændrede måden proteiner orienterede sig på overfladerne og ændrede deres struktur, og dette påvirkede proteinstabilitet. De fandt ud af, at nanostrukturer med mindre og mere buede overflader begunstigede proteinorienteringer, der resulterede i mere stabile proteiner end strukturer med større mere flade overflader.
For at nå disse konklusioner, forskerne undersøgte flere velstuderede proteiner, herunder cytokrom c, RNase A, og lysozym og overvågede deres adsorption på silica -nanopartikler af forskellig størrelse. I dette seneste værk, de modificerede de adsorberede proteiner kemisk til dannelse af kemiske "tags", der gav forskerne vigtige oplysninger om, hvordan proteinerne adsorberede på forskellige silicaoverflader. Når nanomaterialer og proteiner blev undersøgt ved hjælp af massespektrometri, mærkerne gav værdifuld ny information om proteinernes overfladeorientering. Massespektrometri analyserer massedistributionen af et materiale for at bestemme dets elementære sammensætning og strukturelle egenskaber, og var meget følsom over for de kemiske mærker tilføjet på proteinerne.
 Varme artikler
Varme artikler
-
 Picosecond magnetiseringsdynamik af spin-tilstande afsløret af diffraktiv ferromagnetisk resonansFigur 1:(a) Illustration af opsætningen af diffraktiv ferromagnetisk resonans (DFMR). Prøven placeres på en koplanar bølgeleder, som er monteret inde i det bløde røntgendiffraktometer RASOR på beaml
Picosecond magnetiseringsdynamik af spin-tilstande afsløret af diffraktiv ferromagnetisk resonansFigur 1:(a) Illustration af opsætningen af diffraktiv ferromagnetisk resonans (DFMR). Prøven placeres på en koplanar bølgeleder, som er monteret inde i det bløde røntgendiffraktometer RASOR på beaml -
 På vej til nanotheranosticsNær-infrarød excitation af funktionaliserede bismuthferrit-nanopartikler resulterer i harmonisk emission, der udløser fotorelease af molekylære laster i bur, muliggør afkoblet billeddannelse og kontro
På vej til nanotheranosticsNær-infrarød excitation af funktionaliserede bismuthferrit-nanopartikler resulterer i harmonisk emission, der udløser fotorelease af molekylære laster i bur, muliggør afkoblet billeddannelse og kontro -
 Blinkede nanodiamanter er kun en fase, forskerholdet finderEt transmissionselektronmikroskopbillede viser et nanodiamantgitter. Rice University kemikere brugte deres flash Joule-opvarmningsteknik til at kontrollere faseudviklingen og dopingen af kulstof. Kr
Blinkede nanodiamanter er kun en fase, forskerholdet finderEt transmissionselektronmikroskopbillede viser et nanodiamantgitter. Rice University kemikere brugte deres flash Joule-opvarmningsteknik til at kontrollere faseudviklingen og dopingen af kulstof. Kr -
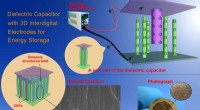 Nanoteknologi tilbyder en ny tilgang til at øge lagringskapaciteten for dielektriske kondensatorerEt diagram over den dielektriske kondensatorforskning udviklet af et University of Delaware-ledet forskerhold. Kredit:Kathy F. Atkinson/University of Delaware 21. oktober kl. 2015, var den dag, hv
Nanoteknologi tilbyder en ny tilgang til at øge lagringskapaciteten for dielektriske kondensatorerEt diagram over den dielektriske kondensatorforskning udviklet af et University of Delaware-ledet forskerhold. Kredit:Kathy F. Atkinson/University of Delaware 21. oktober kl. 2015, var den dag, hv
- Grøntsagssammensætning kan have en central rolle i behandling af Alzheimers sygdom
- Infusion af maskinlæringsmodeller med induktive skævheder for at fange menneskelig adfærd
- Intelligente metamaterialer opfører sig som elektrostatiske kamæleoner
- Strålingslækager i Japans plutoniumlaboratorium, ingen arbejdere udsat
- Hvilken stor signatur kan sige om din personlighed
- Sådan beregner du den kalorimeter, der er opnået


