Hvad skete der med strukturen af catecholoxidase ved temperaturer over 75C?
1. Øget molekylær bevægelse: Forhøjede temperaturer får molekyler til at vibrere mere kraftigt.
2. Svækkelse af ikke-kovalente obligationer: Denne øgede bevægelse forstyrrer det delikate netværk af brintbindinger, hydrofobe interaktioner og van der Waals-kræfter, der holder proteins tredimensionelle struktur sammen.
3. Udfoldelse af proteinet: Når disse ikke-kovalente bindinger svækkes, begynder proteinet at udfolde sig. Dens alfa-helikser og beta-ark, der er ansvarlige for enzymets specifikke form, løsner sig.
4. Tab af aktivt sted: Det aktive sted, det specifikke område på enzymet, hvor underlaget (i dette tilfælde, catechol) binder, er ofte placeret i en bestemt lomme eller rille dannet af det foldede protein. Denaturering forstyrrer dette aktive sted, hvilket gør enzymet ikke i stand til at binde til underlaget.
5. Tab af katalytisk aktivitet: Da det aktive sted ikke længere er funktionelt, kan enzymet ikke længere katalysere oxidationen af Catechol.
Konsekvenser af denaturering:
* Tab af enzymfunktion: Enzymet er ikke længere i stand til at udføre sin biologiske rolle.
* Mulig aggregering: Denaturerede proteiner kan undertiden klumpe sammen og danne aggregater. Disse aggregater kan være skadelige for celler og væv.
reversibilitet:
I nogle tilfælde, hvis temperaturen sænkes langsomt, kan proteinet muligvis genfoldes tilbage til dets oprindelige struktur og genvinde en vis aktivitet. Ved højere temperaturer er denaturering imidlertid ofte irreversibel.
I resumé forstyrrer temperaturerne over 75 ° C den komplicerede struktur af catecholoxidase, hvilket fører til dens denaturering, tab af aktivitet og potentielt irreversibel skade.
Sidste artikelHar en vandmand kompleks kemi?
Næste artikelHvorfor er glas cosideret for at være en blanding, der ikke er sammensat?
 Varme artikler
Varme artikler
-
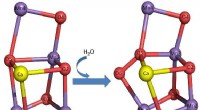 Mekanisme for fotosyntetisk vandopdeling afsløret af en røntgenfri elektronlaserFigur 1:Strukturelle ændringer af Mn4CaO5-klyngen induceret af to lysglimt. S1-tilstand:uden belysning; S3-tilstand:efter to lysglimt. Kredit:Okayama University Fotosystem II (PSII) er et enormt m
Mekanisme for fotosyntetisk vandopdeling afsløret af en røntgenfri elektronlaserFigur 1:Strukturelle ændringer af Mn4CaO5-klyngen induceret af to lysglimt. S1-tilstand:uden belysning; S3-tilstand:efter to lysglimt. Kredit:Okayama University Fotosystem II (PSII) er et enormt m -
 Maskinlæring giver en genvej til at simulere interaktioner i materialer til solenergihøstMaskinlæring kan omgå eksplicit beregning af visse materialers adfærd for at accelerere simuleringer af optiske egenskaber af komplekse materialer ved endelig temperatur. Kredit:Argonne National Labor
Maskinlæring giver en genvej til at simulere interaktioner i materialer til solenergihøstMaskinlæring kan omgå eksplicit beregning af visse materialers adfærd for at accelerere simuleringer af optiske egenskaber af komplekse materialer ved endelig temperatur. Kredit:Argonne National Labor -
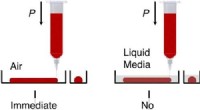 En simpel metode til at printe plane mikrostrukturer af polysiloxanKredit:Singapore University of Technology and Design Polysiloxan er en elastisk polymer, der er meget udbredt i fluidics, optik, og biomedicinsk teknik. Det tilbyder ønskværdige egenskaber til mik
En simpel metode til at printe plane mikrostrukturer af polysiloxanKredit:Singapore University of Technology and Design Polysiloxan er en elastisk polymer, der er meget udbredt i fluidics, optik, og biomedicinsk teknik. Det tilbyder ønskværdige egenskaber til mik -
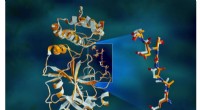 Røntgenstråler gør proteinstrukturen større i hjertet af COVID-19-virusOverlappende røntgendata for SARS-CoV-2-hovedproteasen viser strukturelle forskelle mellem proteinet ved stuetemperatur (orange) og den kryogenfrosne struktur (hvid). Kredit:Jill Hemman/ORNL, US Depar
Røntgenstråler gør proteinstrukturen større i hjertet af COVID-19-virusOverlappende røntgendata for SARS-CoV-2-hovedproteasen viser strukturelle forskelle mellem proteinet ved stuetemperatur (orange) og den kryogenfrosne struktur (hvid). Kredit:Jill Hemman/ORNL, US Depar
- Hvad er den syvende planet tættest på solen?
- Har astronauter brug for solcreme i rummet?
- Forskere bruger grafenkvantepunkter til at detektere fugtighed og tryk
- Skal majsbønder i Afrika syd for Sahara opbevare eller sælge deres korn?
- Er sukker i eddike en kemisk eller fysisk forandring?
- Hvordan reagerer modsatte elektriske ladninger på hinanden?


