Hvordan relateres synteseaktion og nedbrydning?
Synteseaktion:
* Definition: To eller flere reaktanter kombineres for at danne et enkelt, mere komplekst produkt.
* Generel ligning: A + B → AB
* Eksempel: 2H₂ (G) + O₂ (G) → 2H₂O (L) (dannelse af vand fra brint og ilt)
Nedbrydningsreaktion:
* Definition: En enkelt reaktant opdeles i to eller flere enklere produkter.
* Generel ligning: AB → A + B
* Eksempel: 2H₂O (L) → 2H₂ (G) + O₂ (G) (nedbrydning af vand til brint og ilt)
forhold:
* reversible processer: Ofte er syntese- og nedbrydningsreaktioner reversible . Dette betyder, at produkterne fra en nedbrydningsreaktion kan reagere på dannelse af den originale reaktant i en synteseaktion.
* Energiovervejelser: Synteseaktioner kræver normalt energiindgang (endotermisk), mens nedbrydningsreaktioner normalt frigiver energi (eksoterm).
* Nøglekoncept: De er modsatte processer der demonstrerer loven om bevarelse af masse.
Tænk på det som at bygge og rive ned et hus:
* Syntese: Du bruger mursten, mørtel og træ til at bygge et hus (kombinerer stoffer).
* Nedbrydning: Du nedbryder huset og adskiller det tilbage i mursten, mørtel og træ (nedbryder et stof).
Kortfattet: Synteseaktioner opbygges, mens nedbrydningsreaktioner går i stykker. De er i det væsentlige spejlbilleder af hinanden og spiller afgørende roller i mange kemiske processer.
 Varme artikler
Varme artikler
-
 Procesmodellering til mere effektiv fremstilling af papirmasse og papirDaniel Ekbåge. Kredit:Karlstad Universitet Integreret kartonfremstilling består af en række enhedsprocesser, der løbende genererer store mængder procesdata. Fremstilling er energikrævende, og vari
Procesmodellering til mere effektiv fremstilling af papirmasse og papirDaniel Ekbåge. Kredit:Karlstad Universitet Integreret kartonfremstilling består af en række enhedsprocesser, der løbende genererer store mængder procesdata. Fremstilling er energikrævende, og vari -
 Selvsamlende peptider og kampen mod fedme og diabetesFibriller af peptidhormonet Oxyntomodulin, med diametre fra ~6 til 40 nm. Kredit:S. Kinna Et samarbejde mellem Afdelingens Nanoscience Center og MedImmune tager store skridt mod en sikrere og mere
Selvsamlende peptider og kampen mod fedme og diabetesFibriller af peptidhormonet Oxyntomodulin, med diametre fra ~6 til 40 nm. Kredit:S. Kinna Et samarbejde mellem Afdelingens Nanoscience Center og MedImmune tager store skridt mod en sikrere og mere -
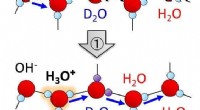 Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto
Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto -
 Forskere fanger øjeblikke med spirende krystaldannelse og vækstFoto af en guldkrystal. Kredit:© Paul Straathof/Pauls Lab Omdannelse af de fleste materialer til organiseret krystallinsk struktur starter med nukleationsprocessen. Et daglig eksempel er den hurti
Forskere fanger øjeblikke med spirende krystaldannelse og vækstFoto af en guldkrystal. Kredit:© Paul Straathof/Pauls Lab Omdannelse af de fleste materialer til organiseret krystallinsk struktur starter med nukleationsprocessen. Et daglig eksempel er den hurti
- Typer af bladmønstre
- Hvad er resultatet af at dyrke en organisme i et næringsmedium kendt som?
- Fødslen af en yngre søskende aktiverer langvarige stressreaktioner hos unge bonoboer
- Hvordan påvirker mennesker geosfæren?
- At bygge bro over kløften:Dataloger udvikler model til at forbedre vanddata fra satellitter
- Hvad er betydningen af reproduktion?


