Hvorfor kan det ikke altid være muligt at bestemme reaktanter og produkter i en reaktion, der forklarer dine svarvilkår for kemisk ligevægt?
Kemisk ligevægt:
* Dynamisk proces: Ligevægt er en dynamisk tilstand, hvor hastighederne for de fremadrettede og omvendte reaktioner er ens. Dette betyder både dannelsen af produkter fra reaktanter og dannelsen af reaktanter fra produkter forekommer samtidig i samme hastighed.
* konstante koncentrationer: Ved ligevægt forbliver koncentrationerne af reaktanter og produkter konstante over tid, selvom reaktionerne fortsætter med at ske.
* Ingen foretrukken retning: Ligevægt betyder ikke, at reaktionen er "stoppet." Det betyder, at der ikke er nogen nettoændring i koncentrationerne af reaktanter og produkter, fordi de fremadgående og omvendte reaktioner er perfekt afbalancerede.
Hvorfor er det vanskeligt at mærke reaktanter og produkter:
1. reversible reaktioner: De fleste kemiske reaktioner er reversible, hvilket betyder, at de kan fortsætte i begge retninger. Ved ligevægt sker de fremadgående og omvendte reaktioner i samme hastighed, så der er ingen klar sondring mellem reaktanter og produkter.
2. Interconversion: Ved ligevægt er reaktanter og produkter konstant sammenkonverterende. Overvej for eksempel reaktionen:
`` `
A + B ⇌ C + D
`` `
Ved ligevægt vil der være en blanding af A, B, C og D, og det er vilkårligt at sige, at A og B er "reaktanter" og C og D er "produkter."
3. skiftende ligevægt: Ændringsbetingelser (som temperatur, tryk eller koncentration) kan flytte ligevægtspunktet, hvilket favoriserer enten den fremadrettede eller omvendte reaktion. Dette betyder, at det, der oprindeligt blev betragtet som et produkt, kunne blive en reaktant under forskellige forhold.
Konklusion:
I en reaktion ved ligevægt bliver etiketterne "reaktanter" og "produkter" mindre meningsfulde, fordi reaktionen er dynamisk og reversibel. Systemet findes i en tilstand, hvor både frem og omvendte processer sker i lige store hastigheder, hvilket resulterer i en stabil blanding af både "reaktanter" og "produkter."
 Varme artikler
Varme artikler
-
 Indsigt i katalyse gennem ny undersøgelse af røntgenabsorptionsspektroskopiManganforbindelser spiller også en rolle som katalysatorer i fotosyntesen. Kredit:HZB Et internationalt hold har fået et gennembrud på BESSY II. For første gang, det lykkedes dem at undersøge elek
Indsigt i katalyse gennem ny undersøgelse af røntgenabsorptionsspektroskopiManganforbindelser spiller også en rolle som katalysatorer i fotosyntesen. Kredit:HZB Et internationalt hold har fået et gennembrud på BESSY II. For første gang, det lykkedes dem at undersøge elek -
 Afdækning af mikrogel-mysterierTC HS AFM-analyse af mikrogeler syntetiseret ved forskellige polymerisationsteknikker:(venstre) præcipitationspolymerisation, (i midten) invers miniemulsionspolymerisation under VPTT, og (højre) omven
Afdækning af mikrogel-mysterierTC HS AFM-analyse af mikrogeler syntetiseret ved forskellige polymerisationsteknikker:(venstre) præcipitationspolymerisation, (i midten) invers miniemulsionspolymerisation under VPTT, og (højre) omven -
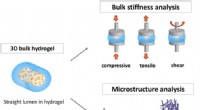 Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid
Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid -
 Ultrahurtig gentagen farvning og farvning af celleprøver til tumordiagnostikKredit:Wiley Ved behandling af tumorer, mikromiljø spiller en vigtig rolle. Den indeholder ofte immunceller, der er så ændrede, at de fremmer tumorvækst. I journalen Angewandte Chemie , forskere
Ultrahurtig gentagen farvning og farvning af celleprøver til tumordiagnostikKredit:Wiley Ved behandling af tumorer, mikromiljø spiller en vigtig rolle. Den indeholder ofte immunceller, der er så ændrede, at de fremmer tumorvækst. I journalen Angewandte Chemie , forskere
- Hvordan tager de tid til, at det tager for lys, der kommer fra solen for at nå jorden?
- Er opløselighed det samme som en kemisk ændring?
- Hvilke planeter er terrestriske planter?
- Luftforurening kan have indflydelse på, hvor glad du er
- I hvilken fase måne er mellem jord og sol?
- Forskere kortlægger, hvordan tilpasningsstrategier for havniveaustigning påvirker økonomier og ov…


