Vil pH af en pufferopløsning være højere eller lavere end svag syre?
* svag syre alene: En svag syre vil delvis ionisere i vand og frigive nogle hydrogenioner (H+). Dette resulterer i en let sur pH.
* bufferopløsning: En pufferopløsning består af en svag syre og dens konjugatbase. Konjugatbasen kan acceptere hydrogenioner, effektivt "opsuge dem" og forhindre, at opløsningen bliver for sur. Dette resulterer i en højere pH sammenlignet med den svage syre alene.
Tænk på det på denne måde: Konjugatbasen fungerer som en "svamp" for brintioner, hvilket gør opløsningen mindre sur (højere pH).
Eksempel:
* Eddikesyre (CH3COOH) er en svag syre. Dens pH vil være let surt.
* En pufferopløsning af eddikesyre og natriumacetat (CH3coona) vil have en højere pH end eddikesyre alene, fordi acetationerne (CH3COO-) kan reagere med overskydende brintioner, hvilket holder pH mere stabil.
Sidste artikelI en katalyseret reaktion kaldes Raectants ofte en?
Næste artikelHvilke forbindelser elueres først i ikke -polær GC -søjle?
 Varme artikler
Varme artikler
-
 Lad sædcyklerne begyndeMenneskelig sæd farvet til test af sædkvalitet i det kliniske laboratorium. Kredit:Bobjgalindo/Wikipedia Hurtigere, billigere og mindre skadelig for DNA, en mikrochip -enhed, der sætter sædceller
Lad sædcyklerne begyndeMenneskelig sæd farvet til test af sædkvalitet i det kliniske laboratorium. Kredit:Bobjgalindo/Wikipedia Hurtigere, billigere og mindre skadelig for DNA, en mikrochip -enhed, der sætter sædceller -
 San Antonio-forskere søger at forhindre luft- og rumfartsfejl og katastrofer med olieudslipProfessor Troconis vil studere brintskørhed på molekylært niveau for at se, hvordan brintatomernes placering påvirker metalmaterialets integritet under de høje tryk og forhøjede temperaturer, der er t
San Antonio-forskere søger at forhindre luft- og rumfartsfejl og katastrofer med olieudslipProfessor Troconis vil studere brintskørhed på molekylært niveau for at se, hvordan brintatomernes placering påvirker metalmaterialets integritet under de høje tryk og forhøjede temperaturer, der er t -
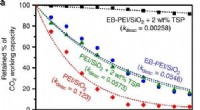 Forskere producerer 50x mere stabilt adsorbentKuldioxid arbejdskapacitet mod oxidativ ældningstid. Udførelsen af den foreslåede metode (sort) forringes meget langsommere (~ 50x) end eksisterende metoder. Det nye adsorbent er således vist at vær
Forskere producerer 50x mere stabilt adsorbentKuldioxid arbejdskapacitet mod oxidativ ældningstid. Udførelsen af den foreslåede metode (sort) forringes meget langsommere (~ 50x) end eksisterende metoder. Det nye adsorbent er således vist at vær -
 Kobber-doteret zinksulfid ændrer farve reversibelt, når det er belyst og kan bruges i smarte adapt…Forskere har opdaget hurtigt skiftende fotokromisme i et billigt uorganisk materiale:kobber-doterede zinksulfid nanokrystaller. Deres resultater baner vejen for et væld af potentielle applikationer li
Kobber-doteret zinksulfid ændrer farve reversibelt, når det er belyst og kan bruges i smarte adapt…Forskere har opdaget hurtigt skiftende fotokromisme i et billigt uorganisk materiale:kobber-doterede zinksulfid nanokrystaller. Deres resultater baner vejen for et væld af potentielle applikationer li
- Hvad er et Wet Bulb Thermometer?
- I slutningen af det 20. århundrede Fox, en ny æra går op for Hollywood
- Stabilitetstjek på Antarktis afslører høj risiko for langsigtet havniveaustigning
- Forskere låser op for fortidens hemmeligheder med en ny international standard for kulstofdatering
- Udskrivning af flydende metaller i tredimensionelle strukturer
- EU går med til at reformere verdens største kulstofmarked


