Hvordan repræsenterer forskere kemiske elementer?
1. Kemiske symboler:
- mest almindelige og grundlæggende metode.
- Hvert element tildeles et unikt symbol på et eller to bogstav, der normalt stammer fra dets latinske eller engelske navn.
- Eksempel:Hydrogen (H), ilt (O), kulstof (C), guld (Au), uran (U).
2. Atomnummer:
- repræsenterer antallet af protoner i en atoms kerne.
- Definerer elementet og dets position på den periodiske tabel.
- Repræsenteret af et helt nummer.
- Eksempel:Hydrogen (atomnummer 1), ilt (atomnummer 8), kulstof (atomnummer 6).
3. Atommasse:
- gennemsnitlig masse af et atom af dette element under hensyntagen til dets isotoper.
- Udtrykt i atommasseenheder (AMU).
- Eksempel:Hydrogen (1.008 AMU), Oxygen (15.999 AMU), Carbon (12.011 AMU).
4. Periodisk tabel:
- organiserer elementer baseret på deres atomnummer og tilbagevendende egenskaber.
- Viser forholdet mellem elementer og hjælper med at forudsige deres reaktivitet og opførsel.
5. Elektronkonfiguration:
- beskriver arrangementet af elektroner i et atoms energiniveau.
- Bruges til at forstå kemisk binding og reaktivitet.
- Eksempel:Hydrogen (1S1), Oxygen (1S2 2S2 2P4), Carbon (1S2 2S2 2P2).
6. Nukleare symboler:
- repræsenterer den specifikke isotop af et element.
- Inkluderer elementets symbol, atomnummer og massetal (antal protoner plus neutroner).
-Eksempel:carbon-12 (¹²c), carbon-14 (¹⁴c).
7. Elementære formler:
- bruges til at repræsentere sammensætningen af molekyler og forbindelser.
- Viser antallet af atomer for hvert tilstedeværende element.
- Eksempel:Vand (H₂O), kuldioxid (co₂), glukose (c₆h₁₂o₆).
Metoden, der bruges til at repræsentere et element, afhænger af den specifikke kontekst, og hvilke oplysninger der skal formidles.
 Varme artikler
Varme artikler
-
 Sjældne jordarters orthoferrit LnFeO3 nanopartikler til bioimagingKredit:Wiley Magnetisk resonansbilleddannelse (MRI) har vist sig som et af de mest kraftfulde kliniske billeddannelsesværktøjer på grund af dens fremragende rumlige opløsning og bløddelskontrast,
Sjældne jordarters orthoferrit LnFeO3 nanopartikler til bioimagingKredit:Wiley Magnetisk resonansbilleddannelse (MRI) har vist sig som et af de mest kraftfulde kliniske billeddannelsesværktøjer på grund af dens fremragende rumlige opløsning og bløddelskontrast, -
 Den molekylære afbøjning af lysstråling ved hjælp af diamantanKredit:Pixabay/CC0 Public Domain Et internationalt hold ledet af kemikeren Heinz Langhals fra Ludwig-Maximilians Universitaet (LMU) i München er lykkedes med den molekylære afbøjning af lysstrålin
Den molekylære afbøjning af lysstråling ved hjælp af diamantanKredit:Pixabay/CC0 Public Domain Et internationalt hold ledet af kemikeren Heinz Langhals fra Ludwig-Maximilians Universitaet (LMU) i München er lykkedes med den molekylære afbøjning af lysstrålin -
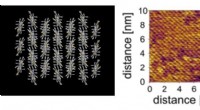 Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i
Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i -
 Proteinanalyse muliggør præcis lægemiddelmålretningProteinmål Kredit:Elena Khavina/MIPT Forskere fra MIPT og flere amerikanske og kinesiske universiteter har løst strukturen af et af de vigtigste nervesystemproteiner i kompleks med en række læge
Proteinanalyse muliggør præcis lægemiddelmålretningProteinmål Kredit:Elena Khavina/MIPT Forskere fra MIPT og flere amerikanske og kinesiske universiteter har løst strukturen af et af de vigtigste nervesystemproteiner i kompleks med en række læge
- Er chlorid et metal eller ikke -metal?
- Hvordan orkaner som Irma og Maria kan ødelægge det caribiske havmiljø
- Er en solsikke monocot eller dicot?
- Kommer gas før fast eller efter fast?
- Afhænger retningen af orkaner af halvkuglen, hvor Hurrianes forekommer?
- Forskere opdager uforudset stjernestort hul


