Proteinanalyse muliggør præcis lægemiddelmålretning
Proteinmål Kredit:Elena Khavina/MIPT
Forskere fra MIPT og flere amerikanske og kinesiske universiteter har løst strukturen af et af de vigtigste nervesystemproteiner i kompleks med en række lægemiddelmolekyler. Opdagelsen åbner muligheder for at udvikle ny medicin med reguleret virkning og færre bivirkninger. Artiklen blev offentliggjort i tidsskriftet Celle .
Mange moderne lægemidler retter sig mod proteiner, da de er ansvarlige for de fleste fysiske og kemiske reaktioner i en celle. Proteinmolekyler sætter også celler i stand til at kommunikere ved at transmittere signaler mellem dem. Når en person bliver syg, harmonien i cellerne er forstyrret, så medicin bruges til at genoprette balancen ved midlertidigt at øge eller reducere aktiviteten af proteiner. Mange af dem har lignende funktioner og har næsten identiske strukturer, hvilket betyder, at ét lægemiddel kan påvirke flere proteintyper. Denne evne hos lægemidler til at interagere med flere proteinmål kaldes polyfarmakologi.
Da den molekylære tilgang til lægemiddeludvikling først blev introduceret, en generel opfattelse blandt farmakologer var, at lægemiddeleffektiviteten afhang af, hvordan en bestemt medicin interagerede med et givet protein. Interaktionen med andre proteintyper, imidlertid, menes kun at forårsage uønskede bivirkninger. Så dengang, hovedformålet med farmakologi var at maksimere selektiviteten - dvs. et lægemiddels evne til kun at målrette mod en bestemt type proteiner. Konceptet fik et metaforisk navn fra nobelprisvinderen Paul Ehrlich, der opfandt udtrykket "magiske kugler" for at henvise til sådanne meget selektive medikamenter.
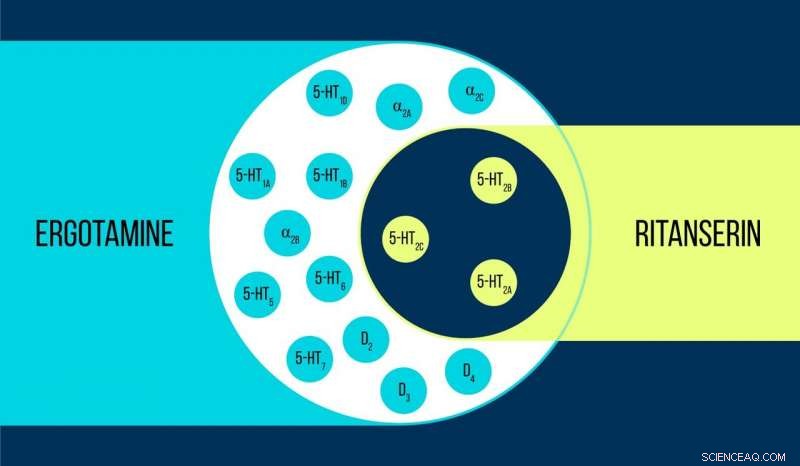
Sammenligning af ergotamin og ritanserin Kredit:Elena Khavina/MIPT
Imidlertid, som det ofte sker, det enkleste koncept er ikke nødvendigvis det mest succesfulde. Fremskridt inden for computerteknologier inden for kemi og biologi gjorde det muligt at producere ekstremt selektive lægemidler, der kun virkede på to eller tre tætte undertyper af et målprotein. Men de var ikke så effektive som deres lavselektivitetsanaloger, når de behandlede komplekse lidelser såsom depression:De polyfarmakologiske profiler af nogle lægemidler viste sig at være vigtige for deres gavnlige virkninger. Det viste sig, at polyfarmakologi ikke nødvendigvis forårsager uønskede bivirkninger, alligevel er det vigtigt at kontrollere, hvilke proteiner der påvirkes. Begrebet "magic bullet" blev således erstattet af "magic shotgun" konceptet, som lægger vægt på lægemidler med en ønsket effekt på en bestemt kombination af mål.
Formålet med denne forskning var at identificere de strukturelle egenskaber af proteiner, der ville forklare, hvorfor nogle lægemidler virker selektivt på dem, og andre ikke gør. For at gennemføre undersøgelsen, forskerne brugte 5-HT2c serotoninreceptoren - et signalprotein placeret i cellemembranen, som bliver aktiveret af serotonin til at modtage signaler fra naboceller. Receptoren har en række vigtige funktioner. Først, det bruges allerede som et valideret mål for medicin mod fedme, samtidig med at det er et potentielt terapeutisk mål for flere psykiske lidelser. Sekund, det er målrettet af en række lægemidler med en bred vifte af selektiviteter, gør det muligt at sammenligne dem. For det tredje, en menneskekrop har over 800 andre receptorer, der i struktur ligner 5-HT2c, men har forskellige funktioner. Det er derfor, dets ikke-selektive antagonister ofte har et væld af bivirkninger.
Vsevolod Katritch, en gæsteprofessor ved MIPT, siger, "Vi brugte to kemikalier til at arbejde med 5-HT2c serotoninreceptoren:ergotamin og ritanserin. Ergotamin er en ikke-selektiv agonist med en bred polyfarmakologisk profil:Det påvirker serotonin, dopamin, og adrenerge receptorer. Ritanserin, derimod har en mere snæver profil [figur 1] og er den 5-HT2c-receptorselektive inverse agonist. Dermed, 5-HT2c-atomstrukturerne opnået i kompleks med ergotamin og ritanserin hjælper ikke kun med at forklare forskellene mellem aktive og inaktive receptortilstande - hvilket i sig selv er en betydelig præstation - men også med at finde ud af årsagerne til en sådan molekylær selektivitet."
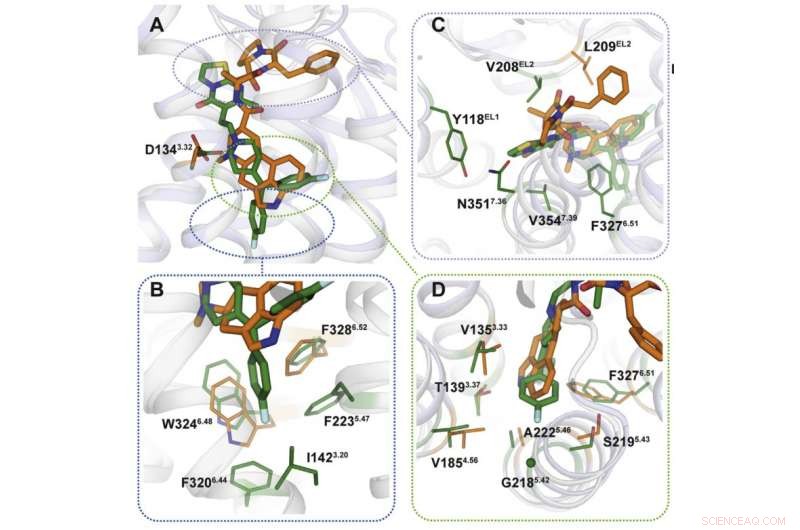
Kredit:Moscow Institute of Physics and Technology
Ved hjælp af røntgenkrystallografi, forskerne opnåede en 3-D-model af proteiner i det øjeblik, de interagerer med lægemidler. Forudsigeligt, bindingsmekanismerne for medicinen var forskellige (figur 2). De bindingssteder, der er målrettet af ergotamin, er ens i mange proteiner, hvilket forklarer kemikaliets ikke-selektivitet. Ritanserin, på den anden side, interagerer forskelligt med receptoren og virker kun på nogle af dens fragmenter, der er unikke for en lille gruppe proteiner. Introduktion af flere mutationer, der ændrer disse fragmenter i 5HT2c-receptorgenet, forskerne bemærkede, at interaktionen med ritanserin blev mindre effektiv - det faktum, der bekræftede, at disse proteinområder er dem, der er ansvarlige for kemikaliets selektivitet.
Petr Popov, en forsker ved MIPT's Laboratory of Structural Biology of G-protein-koblede receptorer, siger, "Den største udfordring med at identificere receptorstrukturer var at opnå en stabil, gensplejset konstruktion, der ville være velegnet til krystallisering, og som vi kunne arbejde med og studere. Ved at bruge den bioinformatiske tilgang og maskinlæringsmetoder, vi har identificeret stabiliserende punktmutationer for 5HT2c-receptoren både i dens aktive og inaktive tilstand."
Dermed, analysen af de strukturelle karakteristika af proteiner i kompleks med lægemidler med varierende selektivitet viste sig at være effektiv. Det kan bruges til at kontrollere sættet af mål og derfor både de direkte og bivirkninger af en medicin under dens udvikling. Også, sådanne lægemidler vil gavne mange patienter takket være forbedrede terapeutiske profiler, der bekæmper en række sygdomme og har færre bivirkninger.
 Varme artikler
Varme artikler
-
 Hård kærlighed:Intens genskin hjælper næste generations solteknologi gennem den akavede fase660 nm) er fra fase-separeret perovskit drevet af lav-intensitet konfokal mikroskop scanning laser. Kredit:ARC Center of Excellence in Exciton Science Forskere i Australien har løst en grundlæggen
Hård kærlighed:Intens genskin hjælper næste generations solteknologi gennem den akavede fase660 nm) er fra fase-separeret perovskit drevet af lav-intensitet konfokal mikroskop scanning laser. Kredit:ARC Center of Excellence in Exciton Science Forskere i Australien har løst en grundlæggen -
 Forskere finder et potentielt potentielt våben til at overvinde antibiotikaresistensPseudomonas aeruginosa-producerede rhamnolipider målretter mod plasmamembranen af Staphylococcus aureus (mærket her med rødt) for at øge permeabiliteten for aminoglycosidantibiotika. Kredit:Conlon L
Forskere finder et potentielt potentielt våben til at overvinde antibiotikaresistensPseudomonas aeruginosa-producerede rhamnolipider målretter mod plasmamembranen af Staphylococcus aureus (mærket her med rødt) for at øge permeabiliteten for aminoglycosidantibiotika. Kredit:Conlon L -
 Forandrende resultater skubber 3D-print til den molekylære grænseKredit:University of Nottingham New University of Nottingham forskning beviser, at avancerede materialer, der indeholder molekyler, der skifter tilstand som reaktion på miljøstimuli såsom lys, kan
Forandrende resultater skubber 3D-print til den molekylære grænseKredit:University of Nottingham New University of Nottingham forskning beviser, at avancerede materialer, der indeholder molekyler, der skifter tilstand som reaktion på miljøstimuli såsom lys, kan -
 Forskere udvikler vandtrykssensor, der kan udskrives påI tør tilstand (til venstre; her i en vandfri væske) er sensormaterialet lilla, i våd tilstand (f.eks. fra luftfugtighed) bliver den blå. De trykte emner vist her er hver cirka en centimeter brede. Kr
Forskere udvikler vandtrykssensor, der kan udskrives påI tør tilstand (til venstre; her i en vandfri væske) er sensormaterialet lilla, i våd tilstand (f.eks. fra luftfugtighed) bliver den blå. De trykte emner vist her er hver cirka en centimeter brede. Kr
- Klimaændringsrelateret regn for at øge forsikringsomkostningerne
- Interessante videnskabsprojekter
- Australien planlægger måne-rover for at hjælpe NASA med at finde ilt på månen
- Bliver negativ:hvordan Trump har ændret Twitter-fortællingen
- Er Mars jord for tør til at opretholde liv?
- Sjælden meteorit kan rumme hemmeligheder for livet på Jorden


