Hvad reagerer Hafnium med?
reagerer let med:
* ilt: Formularer Hafniumdioxid (HFO2), en meget stabil og inert forbindelse. Dette oxidlag beskytter metallet mod yderligere korrosion.
* halogener: Reagerer med fluor, klor, brom og jod for at danne halogenider som HFCL4.
* syrer: Reagerer med stærke syrer som koncentreret svovlsyre og salpetersyre. Det er relativt modstandsdygtigt over for fortyndede syrer.
* alkalis: Reagerer med stærke alkalier som natriumhydroxid (NaOH) for at danne hafniates.
reagerer langsomt eller under specifikke forhold:
* nitrogen: Formularer Hafnium -nitrid (HFN) ved høje temperaturer.
* carbon: Reagerer med kulstof ved forhøjede temperaturer til dannelse af hafniumcarbid (HFC), en meget hård og ildfast forbindelse.
reagerer ikke let med:
* Vand: Hafnium er resistent over for vand ved stuetemperatur på grund af det beskyttende oxidlag.
Faktorer, der påvirker reaktivitet:
* Temperatur: Hafniums reaktivitet øges markant ved forhøjede temperaturer.
* Partikelstørrelse: Fin delt hafniumpulver er mere reaktiv end bulk hafnium.
* tilstedeværelse af andre metaller: Hafnium kan danne legeringer med andre metaller, hvilket kan påvirke dens reaktivitet.
Ansøgninger:
Hafniums reaktivitet anvendes i forskellige applikationer, herunder:
* atomreaktorer: Hafniums evne til at absorbere neutroner gør det velegnet til kontrolstænger i atomreaktorer.
* Materialer med høj temperatur: Hafniums høje smeltepunkt og modstand mod oxidation gør det nyttigt i applikationer med høj temperatur som raketmotorer og jetmotorer.
* Elektronik: Hafniumoxid bruges som et dielektrisk materiale i elektroniske anordninger.
Generelt er Hafnium et reaktivt metal med en lang række anvendelser, stort set på grund af dets evne til at danne stabile og inerte forbindelser med forskellige elementer.
Sidste artikelHvad er saltfunktionerne?
Næste artikelHvad er 4 fysiske egenskaber ved et mineral?
 Varme artikler
Varme artikler
-
 Varme klogere, ikke sværere:Hvordan mikrobølger gør katalytiske reaktioner mere effektiveKonventionel opvarmning kontra mikrobølgeopvarmning. Kredit:Tokyo Institute of Technology Mange reaktioner, som vi bruger til at producere kemiske forbindelser i fødevarer, medicinsk, og industrie
Varme klogere, ikke sværere:Hvordan mikrobølger gør katalytiske reaktioner mere effektiveKonventionel opvarmning kontra mikrobølgeopvarmning. Kredit:Tokyo Institute of Technology Mange reaktioner, som vi bruger til at producere kemiske forbindelser i fødevarer, medicinsk, og industrie -
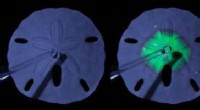 Fra søpindsvinskelet til solcellerDenne billedserie viser et skelet med sanddollar, der gradvist konverterer til en lysemitterende perovskit. Snapshots af denne konvertering er taget på 0s, 5s, 15erne, og 40erne. Kredit:Noorduin Lab,
Fra søpindsvinskelet til solcellerDenne billedserie viser et skelet med sanddollar, der gradvist konverterer til en lysemitterende perovskit. Snapshots af denne konvertering er taget på 0s, 5s, 15erne, og 40erne. Kredit:Noorduin Lab, -
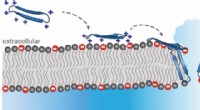 Edderkoppepeptider bekæmper superbugs og kræftKredit:American Chemical Society Efterhånden som antibiotikaresistens stiger, og frygten for superbugs vokser, forskere leder efter nye behandlingsmuligheder. Et fokusområde er antimikrobielle pep
Edderkoppepeptider bekæmper superbugs og kræftKredit:American Chemical Society Efterhånden som antibiotikaresistens stiger, og frygten for superbugs vokser, forskere leder efter nye behandlingsmuligheder. Et fokusområde er antimikrobielle pep -
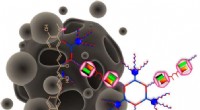 Forskere opdager metode til at levere urtetilskud curcumin til kræftceller ved at løse dets uoplø…Holdet detaljerede en hierarkisk tilgang til at solubilisere et hydrofobt anti-cancer lægemiddel, curcumin i vand via en kombination af koordinationsdrevet selvsamling og vært-gæst interaktioner. Kred
Forskere opdager metode til at levere urtetilskud curcumin til kræftceller ved at løse dets uoplø…Holdet detaljerede en hierarkisk tilgang til at solubilisere et hydrofobt anti-cancer lægemiddel, curcumin i vand via en kombination af koordinationsdrevet selvsamling og vært-gæst interaktioner. Kred
- Hvilke mineraler er til stede i konglomeratklipper?
- Hvad er Talest Mountain i verden, hvor højt det?
- Hvordan adskiller de biotiske faktorer i en savanne sig fra disse chaparral?
- Magnesium beskytter tantal, et lovende materiale til fremstilling af qubits
- Hvordan hindrer videnskaben medicin?
- På sociale medier, plejefamilier delte deres pandemiske bekymringer


