Fordi elektronerne i et molekyle af brintfluorid (HF) trækkes stærkere mod fluoratom er ikke -polært.?
* Elektronegativitet: Fluor (F) er meget mere elektronegativ end brint (H). Dette betyder, at fluor har en stærkere attraktion for delte elektroner i en binding.
* polær kovalent binding: Forskellen i elektronegativitet mellem fluor og brint skaber en polær kovalent binding. Dette betyder, at elektronerne ikke deles ens, hvilket resulterer i en delvis negativ ladning (Δ-) på fluoratomet og en delvis positiv ladning (δ+) på brintatomet.
* molekylært dipolmoment: På grund af den ujævne fordeling af ladning har HF -molekylet et netto dipolmoment. Dette dipolmoment gør molekylet polært.
Kortfattet: Den ulige deling af elektroner på grund af forskellen i elektronegativitet mellem brint og fluor fører til et polært molekyle med et dipolmoment.
 Varme artikler
Varme artikler
-
 Nye smarte materialer til at tackle globale udfordringerKredit:Griffith University At forstå, hvordan naturlige materialer skabes, har hjulpet et forskerhold fra Griffith University med at skabe en smart materialeplatform til at hjælpe med at skabe nye
Nye smarte materialer til at tackle globale udfordringerKredit:Griffith University At forstå, hvordan naturlige materialer skabes, har hjulpet et forskerhold fra Griffith University med at skabe en smart materialeplatform til at hjælpe med at skabe nye -
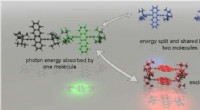 Vejen åbner for at minimere spild i solenergiopsamlingFotonenergiopdeling udføres direkte af to molekyler, ikke via en excimer-tilstand (i rødt). Singlet fissionsmaterialer skal undgå excimerdannelse for at nå det fulde potentiale til at forbedre fotovol
Vejen åbner for at minimere spild i solenergiopsamlingFotonenergiopdeling udføres direkte af to molekyler, ikke via en excimer-tilstand (i rødt). Singlet fissionsmaterialer skal undgå excimerdannelse for at nå det fulde potentiale til at forbedre fotovol -
 Forskere udvikler en kulstoffjeder med høj komprimerbarhed og strækbarhedStamføler fremstillet af kulstoffjeder. Kredit:GAO Huailing Mekanisk fleksibilitet er en nøglefaktor, der bestemmer porøse kulstofmaterialers stabilitet og holdbarhed. Den komprimerende sprødhed a
Forskere udvikler en kulstoffjeder med høj komprimerbarhed og strækbarhedStamføler fremstillet af kulstoffjeder. Kredit:GAO Huailing Mekanisk fleksibilitet er en nøglefaktor, der bestemmer porøse kulstofmaterialers stabilitet og holdbarhed. Den komprimerende sprødhed a -
 Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k
Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k
- Et hidtil uset atlas over koralrev frigivet
- Hvordan arven fra beskidt kul kunne skabe en fremtid for ren energi
- Er menneskelig aktivitet den eneste kilde til forurening?
- Hvorfor rødmer folk?
- Vellykket anden runde af eksperimenter med Wendelstein 7-X
- Undersøgelse tyder på, at solenergi er en god mulighed for bjergrige schweiziske regioner


