Hvordan bestemmer du antallet af subatomære partikler i et atom baseret på dets identitet?
1. Forståelse af det grundlæggende
* atomnummer (z): Dette er antallet af protoner i en atoms kerne. Det definerer elementet. For eksempel har alle carbonatomer 6 protoner (z =6).
* massenummer (a): Dette er det samlede antal protoner og neutroner i en atoms kerne. Det repræsenterer atomets omtrentlige masse.
* Protoner: Positivt ladede partikler fundet i kernen.
* neutroner: Neutralt ladede partikler fundet i kernen.
* Elektroner: Negativt ladede partikler, der kredser om kernen.
2. Bestemmelse af subatomære partikler
* Protoner: Atomnummeret (z) fortæller dig direkte antallet af protoner.
* Elektroner: I et neutralt atom er antallet af elektroner lig med antallet af protoner.
* neutroner: Du kan beregne antallet af neutroner ved at subtrahere atomnummeret (z) fra massetalet (a):
* neutroner =massetal (a) - atomnummer (z)
Eksempel:
Lad os tage eksemplet på carbon-12 (¹²c):
* atomnummer (z) =6 (Dette betyder, at der er 6 protoner)
* massenummer (a) =12
* neutroner =12 - 6 =6
Derfor har et carbon-12-atom:
* 6 protoner
* 6 neutroner
* 6 elektroner
Vigtig note: Isotoper er atomer med det samme element, der har forskellige antal neutroner. Dette betyder, at de har det samme antal protoner, men forskellige massetal. For eksempel har carbon-14 (¹⁴C) 8 neutroner, mens carbon-12 (¹²C) har 6 neutroner.
nøglekoncepter at huske:
* Atomnummeret er det definerende egenskab for et element.
* Massenummeret repræsenterer den omtrentlige masse af et atom.
* I et neutralt atom er antallet af protoner og elektroner ens.
Fortæl mig, hvis du gerne vil arbejde gennem flere eksempler!
Sidste artikelNår en carbonhydridkæde er bøjet, kaldes den?
Næste artikelHvad bliver rødt i prescensen af syre og blå alkali?
 Varme artikler
Varme artikler
-
 Slut med at lege med ilden:Studiet giver indsigt i sikrere genopladelige batterierLithiumdendritter aflejret på overfladen af carbonelektroden detekteres ved hjælp af nuklear magnetisk resonans (NMR) analyse. Mængden af aflejret lithiumdendrit estimeres kvantitativt ud fra 7Li
Slut med at lege med ilden:Studiet giver indsigt i sikrere genopladelige batterierLithiumdendritter aflejret på overfladen af carbonelektroden detekteres ved hjælp af nuklear magnetisk resonans (NMR) analyse. Mængden af aflejret lithiumdendrit estimeres kvantitativt ud fra 7Li -
 Varmevenlige mikrober giver en effektiv måde at bionedbryde plastik påSEM-analyse af PET-film under bionedbrydning ved anvendelse af C. thermocellum helcellebiokatalysator ved 60°C. Kredit:Liu Yajun Forskere i Kina har konstrueret en mikrobe, der viser lovende som g
Varmevenlige mikrober giver en effektiv måde at bionedbryde plastik påSEM-analyse af PET-film under bionedbrydning ved anvendelse af C. thermocellum helcellebiokatalysator ved 60°C. Kredit:Liu Yajun Forskere i Kina har konstrueret en mikrobe, der viser lovende som g -
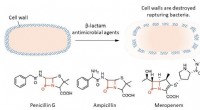 En ny synder i antibakteriel resistens:CysteinpersulfidØverst:β-lactam antimikrobielle midler sprænger bakterier ved at ødelægge deres cellevægge. Nederst:Den røde tekst i strukturformlen repræsenterer β-lactamringen, som er afgørende for bakteriedræbende
En ny synder i antibakteriel resistens:CysteinpersulfidØverst:β-lactam antimikrobielle midler sprænger bakterier ved at ødelægge deres cellevægge. Nederst:Den røde tekst i strukturformlen repræsenterer β-lactamringen, som er afgørende for bakteriedræbende -
 Kompleks liv udviklede sig ud af den tilfældige kobling af små molekylerEt simpelt RNA-molekyle som dette kan have været ansvarlig for udviklingen af komplekst liv, som vi kender det. Kredit:Wits University Kompleks liv, som vi kender det, startede helt tilfældigt,
Kompleks liv udviklede sig ud af den tilfældige kobling af små molekylerEt simpelt RNA-molekyle som dette kan have været ansvarlig for udviklingen af komplekst liv, som vi kender det. Kredit:Wits University Kompleks liv, som vi kender det, startede helt tilfældigt,
- Hvad er ortodokse gas for tændere?
- Nye ideer i søgen efter mørkt stof
- Golfbane putting greens viser deres alder
- Kunne en kontrakt fra det 11. århundrede bevise eksistensen af ægteskab af samme køn i middelal…
- Kan alle kemiske reaktioner i kroppen bevæge sig frem og tilbage?
- Oprettelse af digitale tvillinger af materialer


