For CAF2 KSP svarer til 3,9 x 1011 ved 25c Hvad er opløseligheden af denne temperatur?
1. Skriv opløsningens ligevægt:
CAF₂ (S) ⇌ CA²⁺ (aq) + 2f⁻ (aq)
2. Opret KSP -ekspressionen:
Ksp =[Ca²⁺] [f⁻] ²
3. Definer opløselighed (er):
* Lad 's' repræsentere den molære opløselighed af caf₂.
* Dette betyder, at 's' mol caf₂ opløses pr. Liter opløsning og producerer 's' mol Ca²⁺ og 2's 'mol F⁻.
4. Stedfortræder 'S' i KSP -ekspressionen:
KSP =(S) (2S) ² =4S³
5. Løs for 'S':
* KSP =3,9 x 10⁻¹¹ =4S³
* s³ =(3,9 x 10⁻¹¹)/4
* S =³√ ((3,9 x 10⁻¹¹)/4)
* s ≈ 2,1 x 10⁻⁴ m
Derfor er opløseligheden af CAF₂ ved 25 ° C ca. 2,1 x 10⁻⁴ m.
 Varme artikler
Varme artikler
-
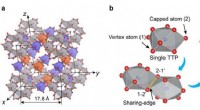 Gennembrud mod løsning af glasets strukturelle mysterium(a) Røde kugler er Pd- og Ni -atomer, hvorimod de blå kugler repræsenterer P -atomer. Den orangefarvede polyeder repræsenterer den Pd-berigede lille klynge, og det blåfarvede polyeder repræsenterer de
Gennembrud mod løsning af glasets strukturelle mysterium(a) Røde kugler er Pd- og Ni -atomer, hvorimod de blå kugler repræsenterer P -atomer. Den orangefarvede polyeder repræsenterer den Pd-berigede lille klynge, og det blåfarvede polyeder repræsenterer de -
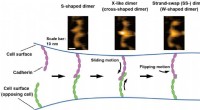 Visualisering af bindingsprocesser af celle-celle-adhæsionsmolekyler i opløsningHS-AFM billeder af cadherin dimererne er vist øverst. Bindingsmekanismen for cadheriner er illustreret i bunden baseret på HS-AFM-observationer. Kredit:Shigetaka Nishiguchi fra videnskabsmænd ved Expl
Visualisering af bindingsprocesser af celle-celle-adhæsionsmolekyler i opløsningHS-AFM billeder af cadherin dimererne er vist øverst. Bindingsmekanismen for cadheriner er illustreret i bunden baseret på HS-AFM-observationer. Kredit:Shigetaka Nishiguchi fra videnskabsmænd ved Expl -
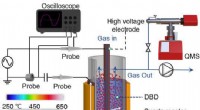 Ikke-termisk plasma-promoveret CO2-hydrogenering i nærværelse af legeringskatalysatorerFigur 1. Kuldioxidgenanvendelse - innovativt plasmakatalysekoncept. Dielektrisk barriereudladningsreaktor med fluidiseret leje blev brugt til CO2-hydrogenering over Pd2 Ga/SiO2 . Kredit:Journal of the
Ikke-termisk plasma-promoveret CO2-hydrogenering i nærværelse af legeringskatalysatorerFigur 1. Kuldioxidgenanvendelse - innovativt plasmakatalysekoncept. Dielektrisk barriereudladningsreaktor med fluidiseret leje blev brugt til CO2-hydrogenering over Pd2 Ga/SiO2 . Kredit:Journal of the -
 Forskning giver ny indsigt i udviklingen af nervesystemetKredit:CC0 Public Domain Banebrydende forskning har givet en fascinerende frisk indsigt i, hvordan dyrs nervesystem udviklede sig fra enkle strukturer til at blive det komplekse netværk, der trans
Forskning giver ny indsigt i udviklingen af nervesystemetKredit:CC0 Public Domain Banebrydende forskning har givet en fascinerende frisk indsigt i, hvordan dyrs nervesystem udviklede sig fra enkle strukturer til at blive det komplekse netværk, der trans
- Hvad er brevet, der repræsenterer denne ligning mgcl2 li3 (PO4) --- MG3 (PO4) 2 licl?
- Reagerer blade på miljøet?
- Er det en kemisk forandring at lave sølvsmykker?
- Frysestøbning - en guide til at skabe hierarkisk strukturerede materialer
- Hvilken gas er steget i koncentration med ca. 0,011 procent de sidste 150 år?
- Naturlige variationer hjælper med at løse et klimapuslespil


