Hvad er en binding baseret på elektronegativitet?
Her er en sammenbrud af bindingstyper baseret på elektronegativitet:
1. Ikke -polær kovalent binding:
* Elektronegativitetsforskel: Tæt på nul (mindre end 0,5)
* Beskrivelse: Elektronerne deles lige mellem de to atomer, fordi de har lignende elektronegativiteter.
* Eksempel: H₂ (brintgas), Cl₂ (klorgas)
2. Polar kovalent binding:
* Elektronegativitetsforskel: Mellem 0,5 og 1,7
* Beskrivelse: Elektronerne deles ulige mellem de to atomer, hvor det mere elektronegative atom har en større andel af elektronerne. Dette resulterer i en delvis positiv ladning (δ+) på det mindre elektronegative atom og en delvis negativ ladning (Δ-) på det mere elektronegative atom.
* Eksempel: H₂O (vand), HCI (hydrogenchlorid)
3. Ionisk binding:
* Elektronegativitetsforskel: Større end 1,7
* Beskrivelse: Det mere elektronegative atom tager helt elektronet (er) fra det mindre elektronegative atom, der danner ioner med modsatte ladninger. Disse ioner tiltrækkes derefter af hinanden af elektrostatiske kræfter.
* Eksempel: NaCl (natriumchlorid), MGO (magnesiumoxid)
Kortfattet:
* lille elektronegativitetsforskel: Ikke -polær kovalent binding
* Moderat elektronegativitetsforskel: Polær kovalent binding
* stor elektronegativitetsforskel: Ionisk binding
Det er vigtigt at bemærke, at dette er generelle retningslinjer, og der kan være en vis overlapning mellem de forskellige obligationstyper. Imidlertid er det afgørende at forstå begrebet elektronegativitetsforskel afgørende for at forudsige den type binding, der dannes mellem to atomer.
 Varme artikler
Varme artikler
-
 Forskere skaber holdbare, vaskbar tekstilbelægning, der kan afvise virusEn illustration viser det behandlede tekstils evne til at afvise væsker. Kredit:University of Pittsburgh Masker, kjoler, og andet personligt beskyttelsesudstyr (PPE) er afgørende for at beskytte s
Forskere skaber holdbare, vaskbar tekstilbelægning, der kan afvise virusEn illustration viser det behandlede tekstils evne til at afvise væsker. Kredit:University of Pittsburgh Masker, kjoler, og andet personligt beskyttelsesudstyr (PPE) er afgørende for at beskytte s -
 Forskere automatiserer analyser af elektrolytkompositioner til aluminiumsproduktionKorrelation mellem de beregnede og certificerede værdier af kryolitkoncentration for kontrolmaterialer. CR - certificerede værdier af kontrolprøver; SGA CR - beregnede værdier, SD - standardafvigelse.
Forskere automatiserer analyser af elektrolytkompositioner til aluminiumsproduktionKorrelation mellem de beregnede og certificerede værdier af kryolitkoncentration for kontrolmaterialer. CR - certificerede værdier af kontrolprøver; SGA CR - beregnede værdier, SD - standardafvigelse. -
 Forskere udvikler nye metoder til at skabe mikrofluidiske enheder med fluorpolymererRepræsentative fluorpolymermikrokanaler, der er fyldt med vand, der indeholder vandige farvestoffer. Kredit:SUTD En lang række applikationer er baseret på mikrofluidiske enheder lavet af silikoneg
Forskere udvikler nye metoder til at skabe mikrofluidiske enheder med fluorpolymererRepræsentative fluorpolymermikrokanaler, der er fyldt med vand, der indeholder vandige farvestoffer. Kredit:SUTD En lang række applikationer er baseret på mikrofluidiske enheder lavet af silikoneg -
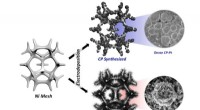 Ny teknik omdanner problemfrit ammoniak til grønt brintKredit:Ulsan National Institute of Science and Technology Et forskerhold ledet af professor Guntae Kim på School of Energy and Chemical Engineering ved UNIST har bebudet et gennembrud inden for te
Ny teknik omdanner problemfrit ammoniak til grønt brintKredit:Ulsan National Institute of Science and Technology Et forskerhold ledet af professor Guntae Kim på School of Energy and Chemical Engineering ved UNIST har bebudet et gennembrud inden for te
- En AI-meddelelsesdekoder baseret på bakterielle vækstmønstre
- Naturligt nanoteknologisk anticancerlægemiddel
- Rumskibet Concordia
- Hvor kan du finde det mest antal vulkaner i verden?
- Kan en elektrisk strøm nedbryde en forbindelse?
- Hvor meget koster det at køre en pære på 400 watt i 18 timer dag med en hastighed på 14,5 kW?


