Hvordan ved du, om den kemiske formel hjælper med at identificere, om et stof er ionisk eller kovalent?
1. Se efter tilstedeværelsen af metaller og ikke -metaller:
* ioniske forbindelser: Typisk dannet mellem metaller og ikke -metaller. Metallet mister elektroner (danner en kation) og de ikke -metalgevinster elektroner (danner en anion).
* Eksempler:NaCl (natriumchlorid), MgO (magnesiumoxid), CaCl₂ (calciumchlorid)
* kovalente forbindelser: Dannet mellem to eller flere ikke -metaller. De deler elektroner for at opnå en stabil elektronkonfiguration.
* Eksempler:H₂O (vand), co₂ (kuldioxid), ch₄ (metan)
2. Polyatomiske ioner:
* ioniske forbindelser: Kan indeholde polyatomiske ioner (grupper af atomer med nettoafgift). Disse ioner behandles ofte som enkeltenheder inden for formlen.
* Eksempler:NH₄CL (ammoniumchlorid), Na₂so₄ (natriumsulfat)
* kovalente forbindelser: Polyatomiske ioner findes ikke i kovalente forbindelser.
3. Præfikser i formlen:
* kovalente forbindelser: Brug præfikser som "mono-", "di-", "tri-" osv. For at indikere antallet af hver type atom i forbindelsen.
* Eksempler:CO (kulilte), CO₂ (kuldioxid)
* ioniske forbindelser: Brug ikke præfikser. Formlen angiver det enkleste forhold mellem ioner.
Vigtige noter:
* Undtagelser findes: Der er nogle forbindelser, der ikke passer pænt ind i disse kategorier. For eksempel kan nogle forbindelser med et metal og ikke -metal være kovalent.
* Andre faktorer: Elektronegativitetsforskellen mellem elementer kan også bruges til at forudsige bindingstype.
Kortfattet:
Den kemiske formel er et kraftfuldt værktøj til at identificere typen af binding i et stof. Ved at lede efter tilstedeværelsen af metaller og ikke -metaller, polyatomiske ioner og præfikser i formlen, kan du få en god forståelse af, om et stof er ionisk eller kovalent.
 Varme artikler
Varme artikler
-
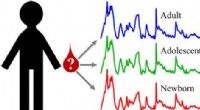 Brug af blodpletter på gerningssteder for at bestemme alderen på en mistænkt eller offerKredit:American Chemical Society Fra sprøjteanalysen gjort berømt i tv -programmet Dexter til den hyppige DNA -profilering af CSI og de reelle sager, der er omfattet af FBI filer , blodprøve
Brug af blodpletter på gerningssteder for at bestemme alderen på en mistænkt eller offerKredit:American Chemical Society Fra sprøjteanalysen gjort berømt i tv -programmet Dexter til den hyppige DNA -profilering af CSI og de reelle sager, der er omfattet af FBI filer , blodprøve -
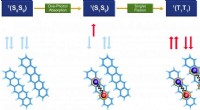 Banebrydende kvantekemiteknik til beregningsdesign og optimering af organiske fotofunktionelle mater…Billede 1. Singlet-fissionsprocessen i pentacen-dimer:den indledende singlet-exciton S1S0 af en monomer deler sig i to frie triplet-excitoner T1-T1 via et korreleret triplet-par 1 (TT) ligeligt fordel
Banebrydende kvantekemiteknik til beregningsdesign og optimering af organiske fotofunktionelle mater…Billede 1. Singlet-fissionsprocessen i pentacen-dimer:den indledende singlet-exciton S1S0 af en monomer deler sig i to frie triplet-excitoner T1-T1 via et korreleret triplet-par 1 (TT) ligeligt fordel -
 Forskere koder Wizard of Oz i en forsvindende lille plastikForskere gemte data i den kemiske struktur af en polymer, blandede dem i blækket i et personligt brev, sendte det med post og var i stand til at hente en kompleks krypteringsnøgle og dekryptere en kop
Forskere koder Wizard of Oz i en forsvindende lille plastikForskere gemte data i den kemiske struktur af en polymer, blandede dem i blækket i et personligt brev, sendte det med post og var i stand til at hente en kompleks krypteringsnøgle og dekryptere en kop -
 Forskere opdager, at tung elementkemi kan ændre sig ved højt trykCurium krystaller med en orange glød, som forskerne brugte til at overvåge ændringerne i kemien, mens de påførte pres. Kredit:Thomas Albrecht-Schmitt / Nature Ny forskning viser, at et af de tunge
Forskere opdager, at tung elementkemi kan ændre sig ved højt trykCurium krystaller med en orange glød, som forskerne brugte til at overvåge ændringerne i kemien, mens de påførte pres. Kredit:Thomas Albrecht-Schmitt / Nature Ny forskning viser, at et af de tunge
- På en planet i forandring, NASA bliver grøn
- Overfyldte plademetoder i mikrobiologi
- Vulkanudbrud forårsagede engang masseudryddelser i havene - kunne klimaændringer gøre det samme?
- Hvem opfandt NASA Weather Satellite?
- Hvordan kan du se, om et blad frigiver vand eller ilt?
- Sådan beregnes 3-faset line-til-jord spænding


