Hvordan forklarer du udtrykket som opløser med hensyn til polære og ikke -polære stoffer?
polære stoffer opløses i polære opløsningsmidler og ikke -polære stoffer opløses i ikke -polære opløsningsmidler.
Her er en sammenbrud:
* polære stoffer Har molekyler med ujævne fordelinger af elektrondensitet. Dette skaber en adskillelse af ladninger inden for molekylet, der danner en delvis positiv (+) og en delvis negativ (-) ende. Eksempler inkluderer vand (H₂O), ethanol (C₂H₅OH) og sukker (C₁₂H₂₂O₁₁).
* ikke -polære stoffer har molekyler med jævnt fordelt elektrondensitet. De har ikke signifikant ladningsadskillelse. Eksempler inkluderer olie, benzin og fedt.
hvordan det fungerer:
Når et polært stof opløses i et polært opløsningsmiddel, tiltrækkes den positive ende af det opløste molekyle af den negative ende af opløsningsmidletmolekylet, og vice versa. Denne attraktion overvinder kræfterne, der holder de opløste molekyler sammen, så de kan sprede sig i hele opløsningsmidlet.
Tilsvarende opløses ikke -polære stoffer i ikke -polære opløsningsmidler, fordi de svage intermolekylære kræfter mellem molekylerne er ens, hvilket giver dem mulighed for at interagere og blande.
hvorfor "som opløses som":
Nøglen er naturen af de intermolekylære kræfter . Polære molekyler interagerer gennem stærkere dipol-dipol kræfter og hydrogenbinding. Ikke -polære molekyler interagerer primært gennem svagere London -spredningskræfter.
Når stoffer med lignende intermolekylære kræfter blandes, kan de interagere effektivt, hvilket fører til opløsning. Men hvis de intermolekylære kræfter er meget forskellige (som polære og ikke -polære), er tiltrækningen mellem molekylerne svag, hvilket forhindrer dem i at opløse.
Eksempel:
* vand (polær) og salt (polær): Salt opløses i vand, fordi begge er polære. De positive natriumioner (Na⁺) i salt tiltrækkes af den negative ilt ende af vandmolekyler, og de negative chloridioner (CL⁻) tiltrækkes af den positive brintende.
* olie (ikke -polær) og vand (polær): Olie opløses ikke i vand, fordi de er forskellige polariteter. De svage London -spredningskræfter mellem oliemolekyler er ikke stærke nok til at overvinde den stærke hydrogenbinding mellem vandmolekyler.
Konklusion:
Udtrykket "som opløser som" fremhæver betydningen af molekylær polaritet ved bestemmelse af opløselighed. At forstå dette koncept er afgørende for at forudsige opførsel af forskellige stoffer, når de er blandet, især i hverdagen og kemiske reaktioner.
 Varme artikler
Varme artikler
-
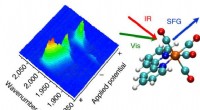 Laserteknik kan åbne døren til mere effektive rene brændstofferKredit:University of Liverpool Forskning fra University of Liverpool kan hjælpe videnskabsmænd med at frigøre det fulde potentiale af nye rene energiteknologier. At finde bæredygtige måder at ers
Laserteknik kan åbne døren til mere effektive rene brændstofferKredit:University of Liverpool Forskning fra University of Liverpool kan hjælpe videnskabsmænd med at frigøre det fulde potentiale af nye rene energiteknologier. At finde bæredygtige måder at ers -
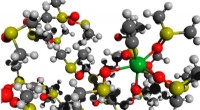 En ny strategi for grønnere anvendelse af calciumcarbidBorn-Oppenheimer molekylær dynamik af et acetylidmolekyle HO-Ca-CCH solvatiseret i DMSO. Kredit:Mikhail Polynski, assistentlærer ved Institute of Chemistry ved St Petersburg University Calciumacet
En ny strategi for grønnere anvendelse af calciumcarbidBorn-Oppenheimer molekylær dynamik af et acetylidmolekyle HO-Ca-CCH solvatiseret i DMSO. Kredit:Mikhail Polynski, assistentlærer ved Institute of Chemistry ved St Petersburg University Calciumacet -
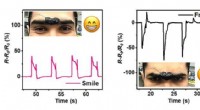 Elektronisk hud strakt til nye grænserSignaler fra den elektrisk ledende hydrogel kan tydeligt skelne mellem forskellige ansigtsudtryk. Kredit:2018 KAUST En elektrisk ledende hydrogel, der kræver strækbarhed, selvhelbredende og belast
Elektronisk hud strakt til nye grænserSignaler fra den elektrisk ledende hydrogel kan tydeligt skelne mellem forskellige ansigtsudtryk. Kredit:2018 KAUST En elektrisk ledende hydrogel, der kræver strækbarhed, selvhelbredende og belast -
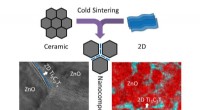 Sintring af atomisk tynde materialer med keramik nu muligtDen skematiske illustration, der viser co-sintring af keramik og 2-D materialer ved hjælp af kold sintringsbehandling, og TEM-billede og energidispersiv spektroskopi (EDS) kort over koldsintret 99ZnO-
Sintring af atomisk tynde materialer med keramik nu muligtDen skematiske illustration, der viser co-sintring af keramik og 2-D materialer ved hjælp af kold sintringsbehandling, og TEM-billede og energidispersiv spektroskopi (EDS) kort over koldsintret 99ZnO-
- NIST-opdagelse kan øge nøjagtigheden ved måling af blodgennemstrømning til kræftdiagnose, andre…
- Vil vi vende det lille fremskridt, vi har gjort med hensyn til miljøretfærdighed?
- Der er systemer, der bevogter dine data i cyberspace, men hvem bevogter vagterne?
- Gadgetproducenter på Consumer Electronics Show omfavner tilslutningsmuligheder
- Ligesom en hovedsekvensstjerne med lav masse løber tør for brændstof i sin kerne, bliver det fakt…
- Hvilken er mere følsom testfehlings eller Benedicts test?


