Hvorfor bliver volumen gas mindre, når det afkøles?
1. Nedsat kinetisk energi:
* Gasmolekyler er konstant i bevægelse, og deres kinetiske energi er direkte proportional med temperaturen.
* Når temperaturen falder, bremser molekylerne, hvilket betyder, at de har mindre kinetisk energi.
* Denne reduktion i kinetisk energi får molekylerne til at bevæge sig mindre kraftigt og kollidere mindre ofte med hinanden og containerens vægge.
2. Nedsat tryk:
* Når molekylerne bevæger sig langsommere, udøver de mindre kraft på beholdervæggene, hvilket resulterer i lavere tryk.
* Da trykket er omvendt proportionalt med volumen (ved konstant temperatur), fører faldet i trykket til en reduktion i volumen.
3. Nedsat afstand mellem molekyler:
* Med mindre energi er molekylerne mindre tilbøjelige til at overvinde de attraktive kræfter mellem dem.
* Dette gør det muligt for molekylerne at bevæge sig tættere sammen, hvilket reducerer det samlede volumen af gassen.
Kortfattet:
Afkøling af en gas reducerer dens molekylers kinetiske energi, hvilket fører til et fald i tryk og en stigning i de attraktive kræfter mellem molekyler. Dette får molekylerne til at bevæge sig tættere sammen, hvilket resulterer i et mindre volumen.
Vigtig note:
Denne opførsel gælder for ideelle gasser , som er teoretiske gasser, der følger specifikke love. Ægte gasser afviger lidt fra denne opførsel, især ved høje tryk og lave temperaturer. Imidlertid forbliver det grundlæggende princip det samme:et fald i temperaturen fører generelt til et fald i volumenet af en gas.
Sidste artikelHvorfor skal nedbrudsprodukterne være opløselige i vand?
Næste artikelKan carbontetrachlorid synke i svovlsyre?
 Varme artikler
Varme artikler
-
 Stabile katalysatorer for ny energiCarina Brunnhofer (til venstre), Dominik Dworschak (til højre) Kredit:TU Wien På vej til en CO 2 -neutral økonomi, vi er nødt til at perfektionere en lang række teknologier – inklusive elektroke
Stabile katalysatorer for ny energiCarina Brunnhofer (til venstre), Dominik Dworschak (til højre) Kredit:TU Wien På vej til en CO 2 -neutral økonomi, vi er nødt til at perfektionere en lang række teknologier – inklusive elektroke -
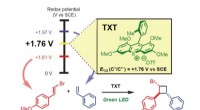 Lys skinner på kemisk produktionsmetodeBilledet illustrerer redoxpotentialet kontrolleret selektiv oxidation af styrener til regio- og stereoselektiv krydsede intermolekylære [2 + 2] cycloaddition via organophotoredox katalyse. Kredit:Yuji
Lys skinner på kemisk produktionsmetodeBilledet illustrerer redoxpotentialet kontrolleret selektiv oxidation af styrener til regio- og stereoselektiv krydsede intermolekylære [2 + 2] cycloaddition via organophotoredox katalyse. Kredit:Yuji -
 Bionedbrydelige plantebeskyttelsesmidler uden risici eller bivirkningerEt hold fra det tekniske universitet i München (TUM) har udviklet et biologisk nedbrydeligt middel, der holder skadedyr på afstand uden at forgifte dem:som myggemiddel, der bruges af badende om sommer
Bionedbrydelige plantebeskyttelsesmidler uden risici eller bivirkningerEt hold fra det tekniske universitet i München (TUM) har udviklet et biologisk nedbrydeligt middel, der holder skadedyr på afstand uden at forgifte dem:som myggemiddel, der bruges af badende om sommer -
 Modulerende foto- og elektroluminescens i et stimuli-responsivt molekylært farvestofKredit:Wiley Kontrol af de exciterede elektroniske tilstande i selvlysende systemer er fortsat en udfordring i udviklingen af fluorescerende og phosphorescerende farvestoffer. Nu, videnskabsmænd
Modulerende foto- og elektroluminescens i et stimuli-responsivt molekylært farvestofKredit:Wiley Kontrol af de exciterede elektroniske tilstande i selvlysende systemer er fortsat en udfordring i udviklingen af fluorescerende og phosphorescerende farvestoffer. Nu, videnskabsmænd
- Sådan beregnes fasevinkler
- Hvordan påvirker solformørkelsesflares atmosfære og magnetfelt?
- Nylige fund fra Islands Fagradalsfjall-udbrud ændrer, hvad vi ved om, hvordan vulkaner fungerer
- Større adgang til prævention fører til højere gradueringsrater
- Hvad er det kemikalie, der gør folk afhængige af alkohol?
- Omdanne affald til biobaserede kemikalier


