Hvorfor kræves katalysator, når brint reagerer med jod?
* fremadrettet reaktion: H₂ (g) + i₂ (g) ⇌ 2HI (g)
* omvendt reaktion: 2HI (g) ⇌ h₂ (g) + i₂ (g)
Mens reaktionen er termodynamisk gunstig, hvilket betyder, at den frigiver energi og bør fortsætte spontant, sker det meget langsomt ved stuetemperatur. Dette skyldes, at reaktionen kræver en høj aktiveringsenergi, som er den minimale energi, der er nødvendig for, at molekylerne kolliderer og bryder deres bindinger for at danne nye.
En katalysator kræves for at fremskynde reaktionen ved at sænke aktiveringsenergien. Katalysatorer tilvejebringer en alternativ vej til, at reaktionen kan forekomme, der involverer et andet sæt mellemtrin med lavere aktiveringsenergi. Dette gør det muligt for reaktionen at ske med en hurtigere hastighed, selv ved stuetemperatur.
Sådan fungerer en katalysator i denne specifikke reaktion:
1. adsorption: Reaktanterne (H₂ og i₂) adsorberer på overfladen af katalysatoren.
2. svækkelse af obligationer: Katalysatoren svækker bindingerne inden for reaktantmolekylerne, hvilket gør dem mere tilbøjelige til at bryde.
3. Dannelse af mellemprodukter: Katalysatoren letter dannelsen af mellemarter, såsom atomhydrogen og jod, på dens overflade.
4. reaktion: De mellemliggende arter reagerer med hinanden for at danne HI.
5. desorption: HI -molekylerne desorberer fra katalysatoroverfladen, hvilket gør det muligt at bruge katalysatoren igen.
Almindelige katalysatorer, der bruges i denne reaktion:
* platin (PT): En meget effektiv katalysator, der ofte bruges i laboratorieindstillinger.
* nikkel (ni): En billigere katalysator, der bruges i industrielle applikationer.
Ved at sænke aktiveringsenergien fremskynder katalysatoren reaktionen markant, hvilket giver mulighed for produktion af hydrogeniodid til en rimelig hastighed.
 Varme artikler
Varme artikler
-
 Forbedring af kvantecomputereKredit:CC0 Public Domain I årtier, eksperter har forudsagt, at kvantecomputere en dag vil udføre vanskelige opgaver, såsom simulering af komplekse kemiske systemer, det kan ikke lade sig gøre med
Forbedring af kvantecomputereKredit:CC0 Public Domain I årtier, eksperter har forudsagt, at kvantecomputere en dag vil udføre vanskelige opgaver, såsom simulering af komplekse kemiske systemer, det kan ikke lade sig gøre med -
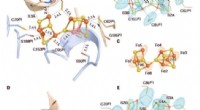 Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A
Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A -
 Kokosolieforbindelser frastøder insekter bedre end DEETEn Manila dværg kokospalme på grunden af Tropical Agriculture Research Station i Mayaguez, Puerto Rico. Kredit:Scott Bauer Forbindelser afledt af kokosolie er bedre end DEET til at frastøde blod
Kokosolieforbindelser frastøder insekter bedre end DEETEn Manila dværg kokospalme på grunden af Tropical Agriculture Research Station i Mayaguez, Puerto Rico. Kredit:Scott Bauer Forbindelser afledt af kokosolie er bedre end DEET til at frastøde blod -
 Filtrering af væsker med væsker sparer strømKredit:CC0 Public Domain Filtrering og behandling af vand, både til konsum og til at rense industrielt og kommunalt spildevand, tegner sig for omkring 13 % af al elektricitet, der forbruges i USA
Filtrering af væsker med væsker sparer strømKredit:CC0 Public Domain Filtrering og behandling af vand, både til konsum og til at rense industrielt og kommunalt spildevand, tegner sig for omkring 13 % af al elektricitet, der forbruges i USA
- Hvad findes mellem planeterne og stjernerne?
- Hvordan holdninger til race, immigration, køn vil påvirke midtvejsvalget i 2018
- Pluto:Er det trods alt en planet?
- Er et horn et resultat af erosion eller aflejring?
- Kan vi genoplive thylacinen? Måske, men det hjælper ikke på den globale udryddelseskrise
- Sådan håndterer du naturens løbske godstog


