Hvordan påvirker temperaturen reaktionshastigheden?
Det grundlæggende:
* kinetisk energi: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Højere temperaturer betyder, at molekyler bevæger sig hurtigere.
* Kollisionsteori: For at en reaktion kan forekomme, skal reaktantmolekyler kollidere med tilstrækkelig energi til at bryde eksisterende bindinger og danne nye.
* Aktiveringsenergi: Hver reaktion har en aktiveringsenergi (EA), som er den minimale energi, der er nødvendig for, at en kollision skal få succes.
Hvordan temperatur påvirker hastigheden:
* øgede kollisioner: Højere temperaturer fører til hyppigere kollisioner mellem reaktantmolekyler på grund af deres øgede hastighed.
* mere effektive kollisioner: Ved højere temperaturer har en større andel af kollisioner nok energi til at overvinde aktiveringsenergibarrieren.
* hastighedskonstant (k): Hastighedskonstanten (K) i en hastighedslovligning er direkte relateret til temperatur. Når temperaturen stiger, øges værdien af K, hvilket indikerer en hurtigere reaktion.
Arrhenius -ligningen:
Forholdet mellem temperatur og hastighedskonstanten kvantificeres ved Arrhenius -ligningen:
k =a * exp (-ea / rt)
Hvor:
* k er hastighedskonstanten
* A er den præ-eksponentielle faktor (relateret til hyppigheden af kollisioner)
* Ea er aktiveringsenergien
* R er den ideelle gaskonstant
* T er den absolutte temperatur (i Kelvin)
Konsekvenser af temperaturændringer:
* Øget sats: Generelt vil øge temperaturen øge reaktionshastigheden. Derfor koger vi mad ved højere temperaturer, og hvorfor mange kemiske processer udføres ved forhøjede temperaturer.
* eksotermiske reaktioner: For eksoterme reaktioner (dem, der frigiver varme), skifter øget temperatur ligevægten mod reaktanterne, hvilket reducerer udbyttet af produkter.
* endotermiske reaktioner: For endotermiske reaktioner (dem, der absorberer varme), skifter øget temperaturen ligevægten mod produkterne, hvilket øger udbyttet af produkter.
Vigtige noter:
* Ikke alle reaktioner: Effekten af temperatur på reaktionshastigheden er ikke universel. Nogle reaktioner kan være ufølsomme over for temperaturændringer, mens andre kan være meget følsomme.
* Andre faktorer: Temperaturen er ikke den eneste faktor, der påvirker reaktionshastighederne. Koncentration, overfladeareal og katalysatorer spiller også betydelige roller.
Kortfattet: Temperatur spiller en afgørende rolle i bestemmelsen af hastigheden af en kemisk reaktion. Højere temperaturer fører generelt til hurtigere reaktionshastigheder på grund af øget kollisionsfrekvens og en større andel af kollisioner, der har tilstrækkelig energi til at overvinde aktiveringsenergibarrieren.
 Varme artikler
Varme artikler
-
 Tilføjelse af en polymer stabiliserer sammenfaldende metal-organiske rammerPolymer seler, placeret i MOFer med store porer, være med til at hæmme sammenbrud af rammerne. Kredit:Li Peng (EPFL) Metalorganiske rammer (MOFer) er en særlig klasse af svampelignende materialer
Tilføjelse af en polymer stabiliserer sammenfaldende metal-organiske rammerPolymer seler, placeret i MOFer med store porer, være med til at hæmme sammenbrud af rammerne. Kredit:Li Peng (EPFL) Metalorganiske rammer (MOFer) er en særlig klasse af svampelignende materialer -
 Biochar kan øge kulstoflageret, men fordele for spiring og vækst synes knappeIllinois Sustainable Technology Center forskere Elizabeth Meschewski, venstre, og Nancy Holm og samarbejdspartnere udviklede en systematisk undersøgelse for at teste effektiviteten af jordadditiv bi
Biochar kan øge kulstoflageret, men fordele for spiring og vækst synes knappeIllinois Sustainable Technology Center forskere Elizabeth Meschewski, venstre, og Nancy Holm og samarbejdspartnere udviklede en systematisk undersøgelse for at teste effektiviteten af jordadditiv bi -
 Forskere bruger nye teknologier for at se vand som aldrig førKredit:Pxhere Fra skabelsen af en enkelt dråbe til strømmen af en flod og verdens hydrologiske kredsløb – hvordan vand binder sammen, og til forskellige overflader, har vidtrækkende konsekvens
Forskere bruger nye teknologier for at se vand som aldrig førKredit:Pxhere Fra skabelsen af en enkelt dråbe til strømmen af en flod og verdens hydrologiske kredsløb – hvordan vand binder sammen, og til forskellige overflader, har vidtrækkende konsekvens -
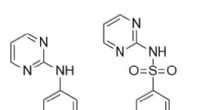 Et antibiotikum, der forklæder sig som en naturlig forbindelse i den gigantiske Madeira-svinDen kemiske forbindelse, som forskerne troede, de opdagede (til venstre) - og hvad de virkelig havde fundet (til højre). Kredit:Luke Robertson En tidligere undersøgelse har vist, at en type fjel,
Et antibiotikum, der forklæder sig som en naturlig forbindelse i den gigantiske Madeira-svinDen kemiske forbindelse, som forskerne troede, de opdagede (til venstre) - og hvad de virkelig havde fundet (til højre). Kredit:Luke Robertson En tidligere undersøgelse har vist, at en type fjel,
- Sådan rydder du op i rumaffald - ved hjælp af spilteori
- Særligt mikroskop fanger defekter i nanorør
- En innovativ metode til at opdage misligholdte deltagere baseret på sparsom rekonstruktion
- Hvad koster asiatiske damebønner?
- Hvilke 3 ting skal være til stede for at lave en elektromagnet?
- Hvordan relaterer processen af fotosyntese og cellulær respiration til hinanden?


