I en kemisk reaktion ændrer katalysatoren 1.potentialet energi af produkter 2. Potentielle reaktanter 3. varme 4.aktiveringsenergi?
* katalysatorens rolle: Katalysatorer fremskynder kemiske reaktioner uden at blive konsumeret i processen. De gør dette ved at tilvejebringe en alternativ reaktionsvej med en lavere aktiveringsenergi.
* Aktiveringsenergi: Aktiveringsenergi er den mindste mængde energi, som molekyler har brug for for at kollidere med tilstrækkelig kraft og korrekt orientering til at bryde bindinger og danne nye, hvilket resulterer i en reaktion.
* Hvordan katalysatorer fungerer: Katalysatorer sænker aktiveringsenergien med:
* stabilisering af overgangstilstanden: Overgangstilstanden er en højenergi, ustabil mellemprodukt i en reaktion. Katalysatorer hjælper med at stabilisere denne tilstand, hvilket gør det lettere at nå.
* Tilvejebringelse af en alternativ vej: Katalysatorer kan binde til reaktanter, bringe dem tættere sammen eller ændre deres orientering, hvilket gør reaktionen mere tilbøjelig til at forekomme.
Lad os se på de andre muligheder:
* Potentiel energi af produkter og reaktanter: Katalysatorer ændrer ikke den samlede energiforskel mellem reaktanter og produkter (dvs. entalpien ændring af reaktionen).
* varme: Mens katalysatorer kan påvirke hastigheden for varmeoverførsel, ændrer de ikke direkte varmen selv.
Kortfattet: Katalysatorer fungerer ved at sænke aktiveringsenergien, hvilket gør det lettere for reaktanter at overvinde energibarrieren og danne produkter.
 Varme artikler
Varme artikler
-
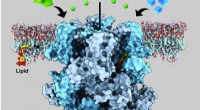 Form af struktur, som nerveceller bruger til at fornemme kulde og menthol, kunne være et nyt mål f…En ionkanal i humane nerveceller kaldet det forbigående receptorpotentielle melastatinelement 8 (TRPM8) registrerer både kulde og menthol, overføre kølende fornemmelser ved at frigive calcium (grønne
Form af struktur, som nerveceller bruger til at fornemme kulde og menthol, kunne være et nyt mål f…En ionkanal i humane nerveceller kaldet det forbigående receptorpotentielle melastatinelement 8 (TRPM8) registrerer både kulde og menthol, overføre kølende fornemmelser ved at frigive calcium (grønne -
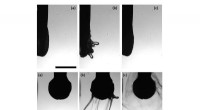 Polymerer forhindrer potentielt farlig tåge under tandlægebesøgBrug af polyakrylsyreopløsning i vand som vandingsvæske i tandplejen reducerer risikoen for aerosolformede patogener. Her, polymeren er vist og danner slangelignende tråde nær spidsen af en vibreren
Polymerer forhindrer potentielt farlig tåge under tandlægebesøgBrug af polyakrylsyreopløsning i vand som vandingsvæske i tandplejen reducerer risikoen for aerosolformede patogener. Her, polymeren er vist og danner slangelignende tråde nær spidsen af en vibreren -
 Smart blæk tilføjer nye dimensioner til 3D-udskrivningEt eksempel fra forskningen viser, hvordan et 3D-printet objekt sammensat af hydrogel (G1) kan ændre størrelse efter udskrivning. Selvom dette eksempel tjener til at demonstrere resultatet, andre obje
Smart blæk tilføjer nye dimensioner til 3D-udskrivningEt eksempel fra forskningen viser, hvordan et 3D-printet objekt sammensat af hydrogel (G1) kan ændre størrelse efter udskrivning. Selvom dette eksempel tjener til at demonstrere resultatet, andre obje -
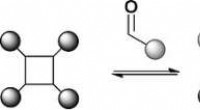 Forskere udvikler nyt kombinatorisk proteinbibliotekKombinatoriske biblioteker er en nøglekomponent i kemikerens værktøjssæt til ligandscreening. Dynamiske kombinatoriske biblioteker tilføjer en ny dimension ved at sammenkæde syntese og screening. Nu,
Forskere udvikler nyt kombinatorisk proteinbibliotekKombinatoriske biblioteker er en nøglekomponent i kemikerens værktøjssæt til ligandscreening. Dynamiske kombinatoriske biblioteker tilføjer en ny dimension ved at sammenkæde syntese og screening. Nu,


