Hvad er alkalimetaller?
Her er alkalimetaller:
* lithium (Li)
* natrium (NA)
* kalium (k)
* Rubidium (RB)
* cesium (CS)
* francium (fr)
Nøgleegenskaber ved alkalimetaller:
* Meget reaktiv: De reagerer let med vand, ilt og andre ikke -metaller.
* blød og sølvfarvet: De kan let klippes med en kniv.
* lav densitet: De er lettere end vand, med undtagelse af lithium.
* Lav smeltnings- og kogepunkter: De er alle faste stoffer ved stuetemperatur, men har relativt lav smeltnings- og kogepunkter sammenlignet med andre metaller.
* Formioniske forbindelser: De mister let en elektron til dannelse af +1 kationer.
Anvendelser af alkalimetaller:
* natrium: Brugt i natriumlamper, sæbeproduktion og som kølemiddel i atomreaktorer.
* kalium: Brugt i gødning, som en komponent af kruttet, og i produktionen af batterier.
* lithium: Brugt i lithium-ion-batterier, psykiatriske medikamenter og som en komponent af visse legeringer.
* Rubidium og Cesium: Brugt i atomur, vakuumrør og i videnskabelig forskning.
* francium: Et radioaktivt element uden praktiske applikationer.
Vigtig note: Alkalimetaller er meget reaktive og skal håndteres med forsigtighed. De bør aldrig opbevares i kontakt med luft eller vand.
 Varme artikler
Varme artikler
-
 Plantebaserede og genanvendelige plastikflasker med citrusskal som råmaterialeKredit:Pixabay/CC0 Public Domain Skiftet fra fossilbaseret til vedvarende bioplast kræver nye effektive metoder. Ny teknologi udviklet på VTT muliggør brugen af pektinholdigt landbrugsaffald, så
Plantebaserede og genanvendelige plastikflasker med citrusskal som råmaterialeKredit:Pixabay/CC0 Public Domain Skiftet fra fossilbaseret til vedvarende bioplast kræver nye effektive metoder. Ny teknologi udviklet på VTT muliggør brugen af pektinholdigt landbrugsaffald, så -
 Positionspecifikke isotopeffekter i butan-et nyt geokemisk sporstofKredit:Pixabay/CC0 Public Domain Positionsspecifik isotopanalyse (PSIA) er en teknik, der måler isotopsammensætningen af en bestemt position i et molekyle. Det kan give værdifuld information om
Positionspecifikke isotopeffekter i butan-et nyt geokemisk sporstofKredit:Pixabay/CC0 Public Domain Positionsspecifik isotopanalyse (PSIA) er en teknik, der måler isotopsammensætningen af en bestemt position i et molekyle. Det kan give værdifuld information om -
 Glas fra en 3-D printerForskellige glasobjekter lavet med en 3-D printer. Kredit:Group for Complex Materials / ETH Zürich ETH-forskere brugte en 3-D printproces til at fremstille komplekse og meget porøse glasobjekter.
Glas fra en 3-D printerForskellige glasobjekter lavet med en 3-D printer. Kredit:Group for Complex Materials / ETH Zürich ETH-forskere brugte en 3-D printproces til at fremstille komplekse og meget porøse glasobjekter. -
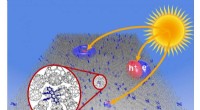 Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden
Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden
- Forbedret AI-proces kunne bedre forudsige vandforsyninger
- Hvilken gruppe af stjerner er den samme farve og tilnærmelsesvis temperatur?
- Hvorfor lilla-kronede gøglerme engagerer sig i kooperativ avl
- Sådan beregnes klasseinterval
- Hvad er frekvensen af en foton med en energi på 4,56 10-19J?
- Separationsteknikker til behandling af vandrensningsanlæg


