Massen ændrer sig ikke under et kemikalie, hvad med fysisk forandring?
Kemiske ændringer:
* masse konserveres. Dette er et grundlæggende princip i kemi, der er kendt som loven om bevarelse af masse. Under en kemisk reaktion omarrangeres atomerne, men de oprettes ikke eller ødelægges. Dette betyder, at den samlede masse af reaktanterne (udgangsmaterialer) skal svare til den samlede masse af produkterne (de dannede stoffer).
* Eksempler: Brændende træ (træ + ilt -> aske + kuldioxid + vand), rust af jern (jern + ilt -> jernoxid), bagning af en kage (mel + æg + sukker + smør -> kage).
Fysiske ændringer:
* masse er også konserveret. Fysiske ændringer ændrer udseendet eller tilstanden af stof, men de involverer ikke ændringer i den kemiske sammensætning af stoffet.
* Eksempler: Smelteis (fast vand -> flydende vand), kogende vand (flydende vand -> gasformigt vand), skærepapir (et stykke papir er opdelt i mindre stykker), opløsning af sukker i vand (sukkermolekyler er spredt i vand, men findes stadig som sukker).
Key Takeaway: Uanset om det er et kemikalie eller en fysisk ændring, forbliver den samlede masse af et lukket system konstant. Dette skyldes, at materie ikke kan oprettes eller ødelægges, kun transformeres fra en form til en anden.
 Varme artikler
Varme artikler
-
 E-næse opsnuser blandinger af flygtige organiske forbindelserEn e-næse MOF-baseret sensor skelner præcist mellem o-xylen, m-xylen og p-xylen fra blandinger. Kredit:Peng Qin Da malingfortynder, blæk og klæbemidler tørrer, kan de frigive flygtige organiske for
E-næse opsnuser blandinger af flygtige organiske forbindelserEn e-næse MOF-baseret sensor skelner præcist mellem o-xylen, m-xylen og p-xylen fra blandinger. Kredit:Peng Qin Da malingfortynder, blæk og klæbemidler tørrer, kan de frigive flygtige organiske for -
 Paradigmeskiftende teori fremhæver vigtigheden af substratfleksibilitet i enzymatiske reaktionerMikroskopisk billede af planteceller af almindelig æblemos (Bartramia pomiformis), med cellevægge, der indeholder xylan. Kredit:Leiden Universitet Leidenske kemikere har foreslået en ny model for
Paradigmeskiftende teori fremhæver vigtigheden af substratfleksibilitet i enzymatiske reaktionerMikroskopisk billede af planteceller af almindelig æblemos (Bartramia pomiformis), med cellevægge, der indeholder xylan. Kredit:Leiden Universitet Leidenske kemikere har foreslået en ny model for -
 En ny metode til at udskrive spejle af variabel størrelse med en reflektionsevne på mere end 99 %Farvet spejllag printet på en folie. Inkjet-udskrivning giver mulighed for strukturering, således at store logoer også kan udskrives. Kredit:Qihao Jin, KIT Dielektriske spejle, også kaldet Bragg-sp
En ny metode til at udskrive spejle af variabel størrelse med en reflektionsevne på mere end 99 %Farvet spejllag printet på en folie. Inkjet-udskrivning giver mulighed for strukturering, således at store logoer også kan udskrives. Kredit:Qihao Jin, KIT Dielektriske spejle, også kaldet Bragg-sp -
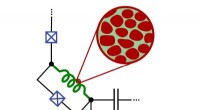 Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin
Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin
- Hvad er energidatsen for synligt lys?
- Kunne punktering af en satellits batteri hjælpe den til at deorbitere hurtigere?
- Biobaseret gødning som løsning til fosfortilstrækkelighed og reducerede drivhusgasemissioner
- Hvordan teleskoper fungerer
- Forskere smider mere end 8.000 stykker affald i en falsk flod for at bekæmpe plastikforurening
- Hvilke typer stjerner har meget høje overfladetemperaturer, men er ikke lysende?


